จุดเดือด จุดหลอมเหลว และสถานะของสาร
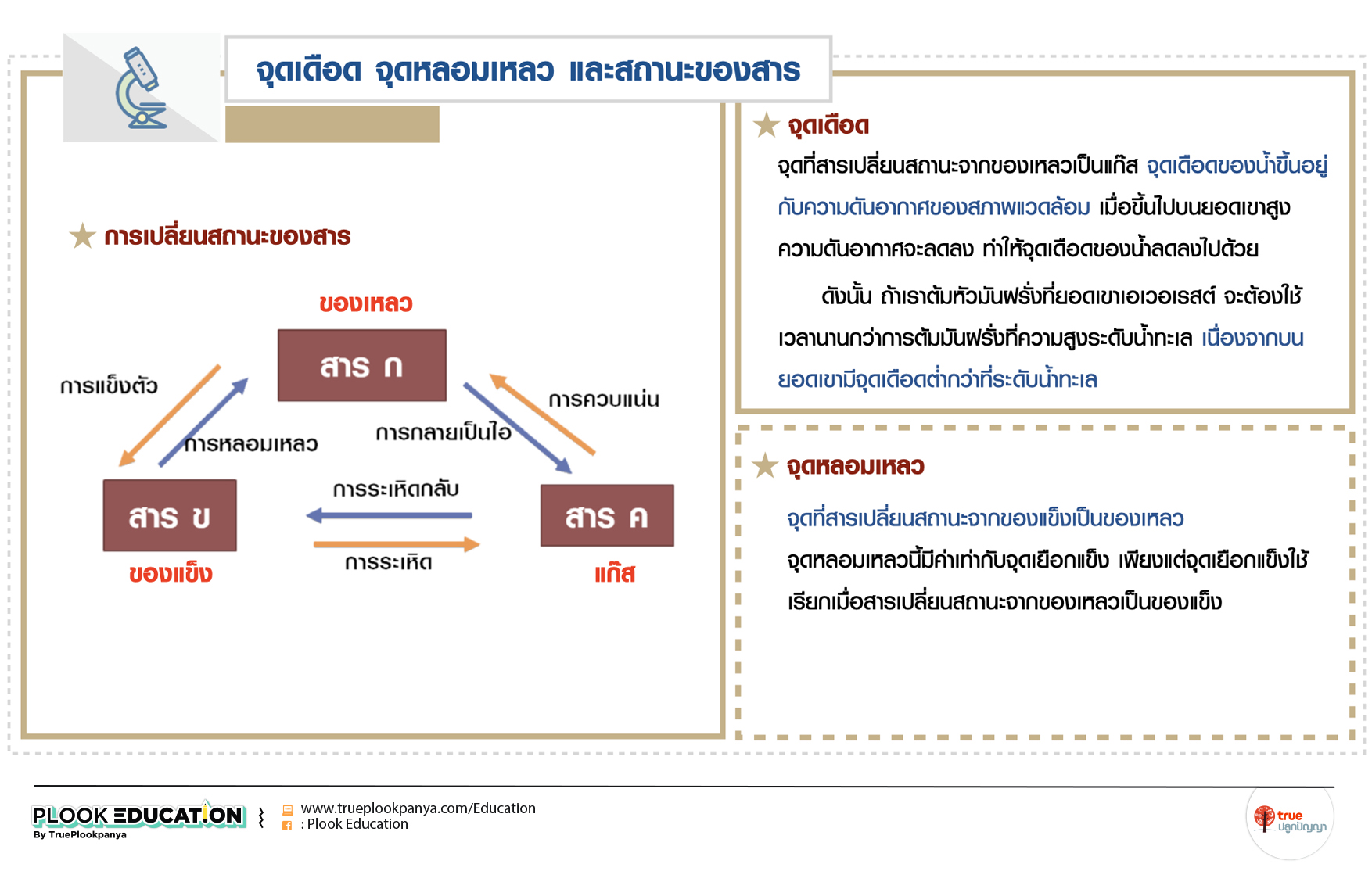

การเปลี่ยนสถานะของสาร
จุดเดือด คือ จุดที่สารเปลี่ยนสถานะจากของเหลวเป็นแก๊ส จุดเดือดของน้ำขึ้นอยู่กับความดันอากาศของสภาพแวดล้อม
เมื่อขึ้นไปบนยอดเขาสูง ความดันอากาศจะลดลง ทำให้จุดเดือดของน้ำลดลงไปด้วย ดังนั้น ถ้าเราต้มหัวมันฝรั่งที่ยอดเขาเอเวอเรสต์ จะต้องใช้เวลานานกว่าการต้มมันฝรั่งที่ความสูงระดับน้ำทะเล เนื่องจากบนยอดเขามีจุดเดือดต่ำกว่าที่ระดับน้ำทะเล
จุดหลอมเหลว คือ จุดที่สารเปลี่ยนสถานะจากของแข็งเป็นของเหลว จุดหลอมเหลวนี้มีค่าเท่ากับจุดเยือกแข็ง เพียงแต่จุดเยือกแข็งใช้เรียกเมื่อสารเปลี่ยนสถานะจากของเหลวเป็นของแข็ง
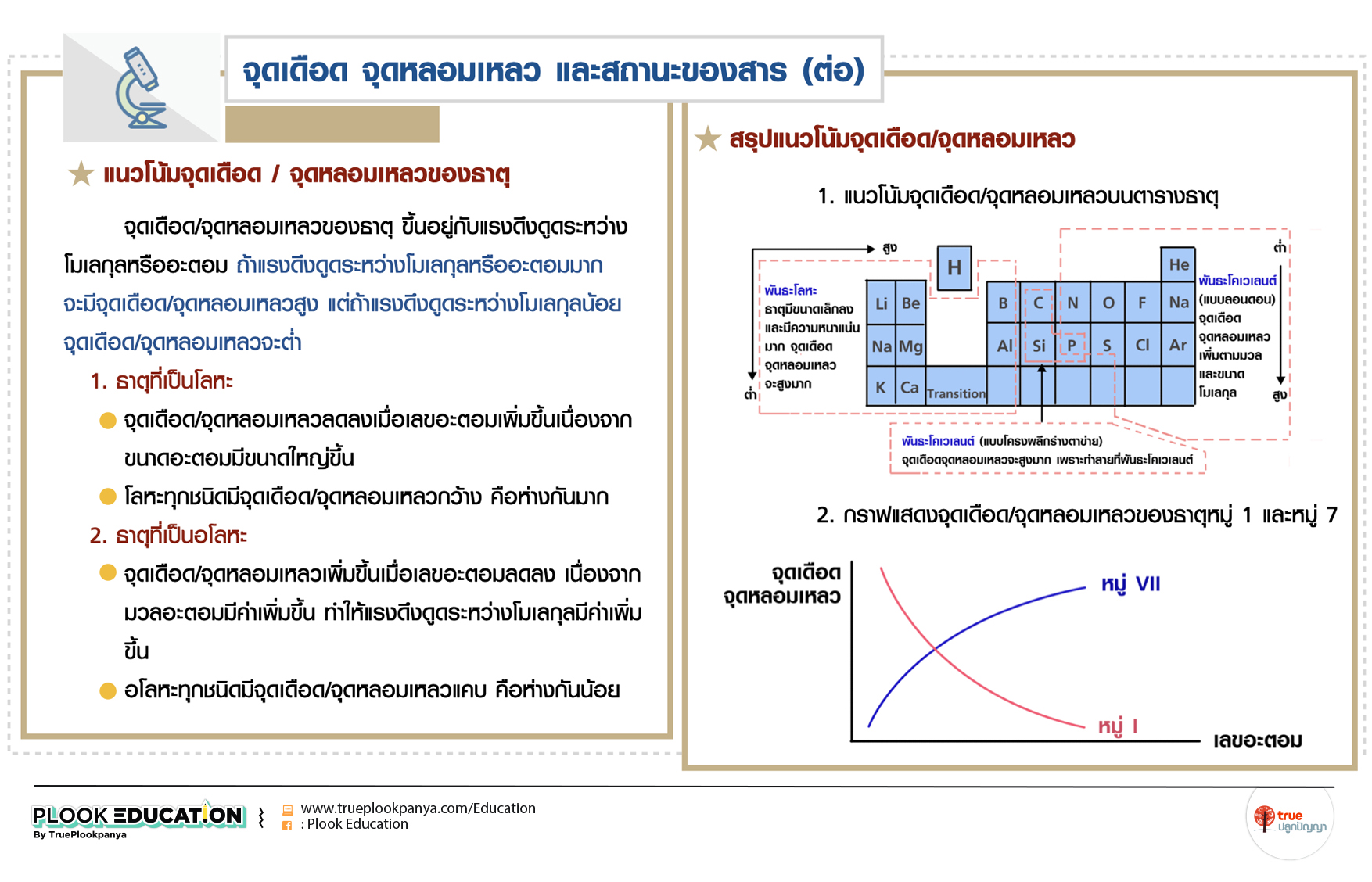
แนวโน้มจุดเดือด/จุดหลอมเหลวของธาตุ
จุดเดือด/จุดหลอมเหลวของธาตุ ขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลหรืออะตอม ถ้าแรงดึงดูดระหว่างโมเลกุลหรืออะตอมมาก จะมีจุดเดือด/จุดหลอมเหลวสูง แต่ถ้าแรงดึงดูดระหว่างโมเลกุลน้อย จุดเดือด/จุดหลอมเหลวจะต่ำ
1. ธาตุที่เป็นโลหะ
- จุดเดือด/จุดหลอมเหลวลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดอะตอมมีขนาดใหญ่ขึ้น
- โลหะทุกชนิดมีจุดเดือด/จุดหลอมเหลวกว้าง คือห่างกันมาก
2. ธาตุที่เป็นอโลหะ
- จุดเดือด/จุดหลอมเหลวเพิ่มขึ้นเมื่อเลขอะตอมลดลง เนื่องจากมวลอะตอมมีค่าเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างโมเลกุลมีค่าเพิ่มขึ้น
- อโลหะทุกชนิดมีจุดเดือด/จุดหลอมเหลวแคบ คือห่างกันน้อย
สมบัติคอลลิเกทีฟ (colligative properties) คือสมบัติของสารละลาย ซึ่งขึ้นอยู่กับความเข้มข้นของสารละลาย ได้แก่
1. การลดลงของอุณหภูมิจุดเยือกแข็ง (freezing point depression)
2. การเพิ่มขึ้นของอุณหภูมิจุดเดือด (boiling point elevation)
3. ความดันไอของสารละลาย (vapor pressure)
4. ความร้อนแฝงของการเป็นไอ (latent heat of vaporization)
5. ความดันออสโมติก (osmotic pressure) เป็นต้น

