การทำนายแนวโน้มและสมบัติของธาตุตามตารางธาตุ



การทำนายแนวโน้มและสมบัติตามตารางธาตุ
1. ขนาดอะตอม
ขนาดอะตอม (Atomic Radius) การบอกขนาดอะตอม จะบอกด้วย “รัศมีอะตอม” โดยจะแบ่งประเภทของรัศมีอะตอมดังนี้
1) รัศมีโคเวเลนต์ (Covalent radius) คือ ระยะทางครึ่งหนึ่งของความยาวพันธะโคเวเลนต์ (พันธะเดี่ยว) ระหว่างอะตอมของธาตุชนิดเดียวกัน
2) รัศมีแวนเดอร์วาลส์ (Van der Waals radius) คือ ระยะทางครึ่งหนึ่งของระยะห่างระหว่างนิวเคลียสของอะตอมที่อยู่ใกล้ที่สุด
3) รัศมีโลหะ (Metallic radius) คือ ระยะทางครึ่งหนึ่งขอ
ธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้น ขนาดอะตอมจะใหญ่ขึ้น เพราะเมื่อเลขอะตอมเพิ่มขึ้น จะมีจำนวนระดับพลังงานเพิ่มขึ้น แม้ว่าจำนวนโปรตอนจะเพิ่มขึ้นด้วยก็ตาม แต่แรงดึงดูดต่อเวเลนซ์อิเล็กตรอนมีน้อย จึงทำให้ขนาดใหญ่ขึ้น กล่าวได้ว่ากรณีนี้การเพิ่มระดับพลังงานมีผลมากกว่าการเพิ่มจำนวนโปรตอน
ธาตุในคาบเดียวกัน เมื่อเลขอะตอมเพิ่มขึ้น ขนาดอะตอมจะเล็กลง เนื่องจากธาตุในคาบเดียวกันมีจำนวนระดับพลังงานเท่ากัน แต่เมื่อเลขอะตอมเพิ่ม จำนวนโปรตอนจะเพิ่มขึ้นด้วย แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนเพิ่มขึ้น ขนาดจึงลดลง
2. รัศมีไอออน
การเกิดเป็นไอออนของโลหะ โลหะจะเกิดเป็นไอออนบวก จำนวนอิเล็กตรอนในอะตอมลดลง ระดับพลังงานของอิเล็กตรอนก็ลดลงด้วย ทำให้แรงดึงดูดระหว่างโปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอนเพิ่มขึ้น ขนาดไอออนจึงเล็กกว่าขนาดอะตอมเดิม
การเกิดเป็นไอออนของอโลหะ อโลหะจะเกิดเป็นไอออนลบจำนวนอิเล็กตรอนในอะตอมเพิ่มขึ้น ทำให้แรงผลักระหว่างอิเล็กตรอนกับอิเล็กตรอน ที่เคลื่อนที่รอบนิวเคลียสเพิ่มขึ้นขอบเขตของกลุ่มหมอกอิเล็กตรอนขยายออกไปจากเดิม ขนาดไอออนจึงใหญ่กว่าขนาดอะตอมเดิม
3. พลังงานไอออไนเซชัน
พลังงานปริมาณที่น้อยที่สุดที่ทำให้อิเล็กตรอนหลุดออกจากอะตอม หรือไอออนในสถานะแก๊ส เรียกว่า พลังงานไอออไนเซชัน เขียนย่อเป็น IE
อะตอมใดมีขนาดเล็ก จะทำให้ดึง e- ออกยาก ⇒ IE สูง
อะตอมใดมีขนาดใหญ่ จะทำให้ดึง e- ออกง่าย ⇒ IE ต่ำ
แนวโน้มของค่า IE ของธาตุตามหมู่และคาบในตารางธาตุ
ตามหมู่ ค่า IE เพิ่มขึ้น เมื่อเลขอะตอมลดลง
ตามคาบ ค่า IE เพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
ยกเว้น หมู่ 2A จะสูงกว่าหมู่ 3A และหมู่ 5A จะสูงกว่า 6A เพราะหมู่ 2A และ 5A จัดเรียงอิเล็กตรอนในระดับพลังงานย่อยเสถียรมาก
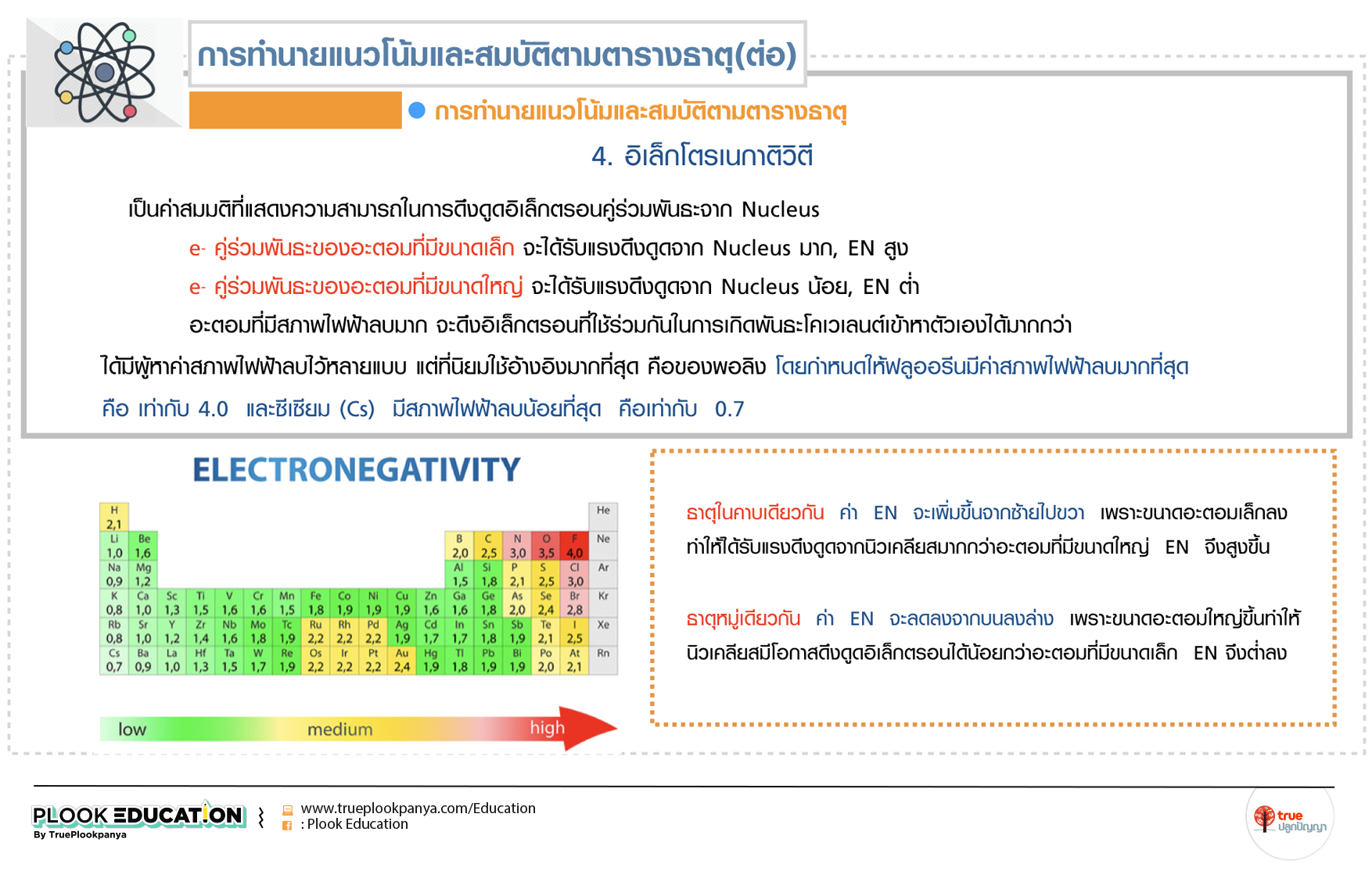
4. อิเล็กโตรเนกาติวิตี
เป็นค่าสมมติที่แสดงความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะจาก Nucleus
e- คู่ร่วมพันธะของอะตอมที่มีขนาดเล็ก จะได้รับแรงดึงดูดจาก Nucleus มาก, EN สูง
e- คู่ร่วมพันธะของอะตอมที่มีขนาดใหญ่ จะได้รับแรงดึงดูดจาก Nucleus น้อย, EN ต่ำ
อะตอมที่มีสภาพไฟฟ้าลบมาก จะดึงอิเล็กตรอนที่ใช้ร่วมกันในการเกิดพันธะโคเวเลนต์เข้าหาตัวเองได้มากกว่า ได้มีผู้หาค่าสภาพไฟฟ้าลบไว้หลายแบบ แต่ที่นิยมใช้อ้างอิงมากที่สุด คือ ของพอลิง โดยกำหนดให้ฟลูออรีนมีค่าสภาพไฟฟ้าลบมากที่สุด คือ เท่ากับ 4.0 และซีเซียม (Cs) มีสภาพไฟฟ้าลบน้อยที่สุด คือเท่ากับ 0.7
ธาตุในคาบเดียวกัน ค่า EN จะเพิ่มขึ้นจากซ้ายไปขวา เพราะขนาดอะตอมเล็กลงทำให้ได้รับแรงดึงดูดจากนิวเคลียสมากกว่าอะตอมที่มีขนาดใหญ่ EN จึงสูงขึ้น
ธาตุหมู่เดียวกัน ค่า EN จะลดลงจากบนลงล่าง เพราะขนาดอะตอมใหญ่ขึ้นทำให้นิวเคลียสมีโอกาสดึงดูดอิเล็กตรอนได้น้อยกว่าอะตอมที่มีขนาดเล็ก EN จึงต่ำลง
5. สัมพรรคภาพอิเล็กตรอน
Electron affinity (EA) คือพลังงานที่ปลดปล่อยออกมาจากการรับอิเล็กตรอนของอะตอมธาตุแล้วเกิดเป็นแอนไอออน ณ สถานะแก๊ส
ธาตุที่มี EA สูง จะคายพลังงานออกมามากเมื่อรับอิเล็กตรอนเข้าไป ทำให้เกิดไอออนลบที่มีความเสถียรมาก ดังนั้นค่า EA จึงใช้ทำนายความสามารถในการเป็นไอออนลบ กล่าวคือ ธาตุที่มี EA สูง จะสามารถเกิดเป็นไอออนลบได้ง่ายกว่าธาตุที่มี EA ต่ำ

