ทุกปฏิกิริยาเคมีที่เกิดขึ้นในโลกนี้ จะเป็นไปตามกฏทรงมวลเสมอ นอกจากนี้ ปฏิกิริยาเคมียังมีความเกี่ยวข้องกับพลังงานเคมี ซึ่งจะเปลี่ยนแปลงไปหลังจากปฏิกิริยาเกิดขึ้น ทำให้เราจำแนกปฏิกิริยาเคมีได้ 2 ชนิด คือ ปฏิกิริยาดูดความร้อน และปฏิกิริยาคายความร้อน
กฏทรงมวลของสาร กล่าวว่า ผลรวมของมวลของสารตั้งต้นในปฏิกิริยาเคมีหนึ่ง เท่ากับผลรวมของมวลของสารผลิตภัณฑ์เสมอ กรณีที่สารตั้งต้นและผลิตภัณฑ์อยู่ในภาชนะเปิด แล้วพบว่ามวลของผลิตภัณฑ์น้อยกว่ามวลของสารตั้งต้น แสดงว่า ผลิตภัณฑ์บางส่วนเป็นแก๊สและออกสู่บรรยากาศไป
ในการเกิดปฏิกิริยาเคมีนอกจากจะมีผลิตภัณฑ์ซึ่งเป็นสารใหม่เกิดขึ้นแล้ว ยังมีพลังงานเกี่ยวข้องด้วยเสมอ เช่น การเผาไหม้เชื้อเพลิงต้องใช้พลังงานความร้อน แล้วได้พลังงานความร้อนและพลังงานแสง
พลังงานเคมี (Chemical energy) เป็นพลังงานศักย์ที่แฝงอยู่ในโครงสร้างของสาร เช่น อยู่ในรูปของน้ำมันเชื้อเพลิง ไขมัน ซึ่งเมื่อเกิดการเผาไหม้ จะปล่อยพลังงานเคมีออกมา และนำมาใช้ประโยชน์ได้ พลังงานเคมีเป็นพลังงานที่มีส่วนเกี่ยวข้อง และสำคัญกับสิ่งมีชีวิตมาก ในการเกิดปฏิกิริยาของสารแต่ละปฏิกิริยานั้น ต้องมีพลังงานเข้ามาเกี่ยวข้องเสมอ การเกิดปฏิกิริยาเคมีมี 2 ขั้นตอน ดังนี้
ขั้นที่ 1 เป็นขั้นที่ดูดพลังงานเข้าไปเพื่อสลายพันธะในสารตั้งต้น
ขั้นที่ 2 เป็นขั้นที่คายพลังงานออกมาเมื่อมีการสร้างพันธะในผลิตภัณฑ์
ถ้าใช้การเปลี่ยนแปลงของพลังงานเป็นเกณฑ์ สามารถแบ่งปฏิกิริยาเคมีออกเป็น 2 ประเภท ดังนี้
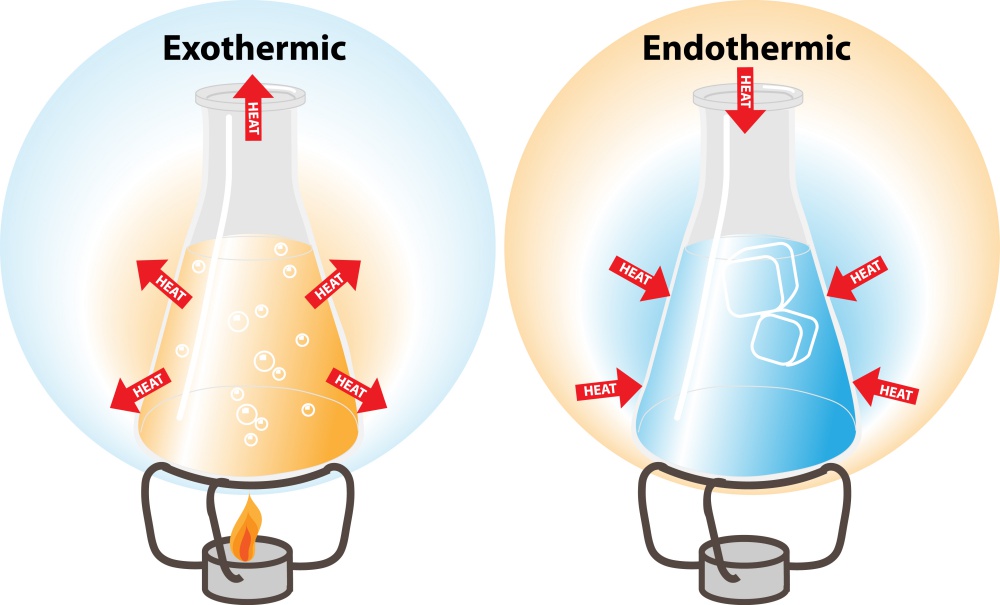
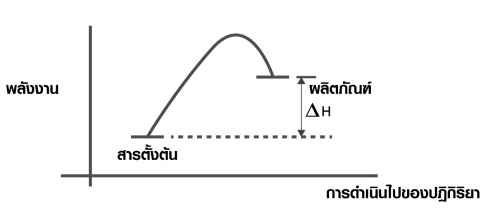
1. ปฏิกิริยาดูดความร้อน (Endothermic reaction)
เป็นปฏิกิริยาที่ดูดพลังงานเข้าไปสลายพันธะ มากกว่าที่คายออกมาเพื่อสร้างพันธะ โดยในปฏิกิริยาดูดความร้อนนี้ สารตั้งต้นจะมีพลังงานต่ำกว่าผลิตภัณฑ์ จึงทำให้สิ่งแวดล้อมเย็นลง อุณหภูมิลดลง เมื่อเอามือสัมผัสภาชนะจะรู้สึกเย็น
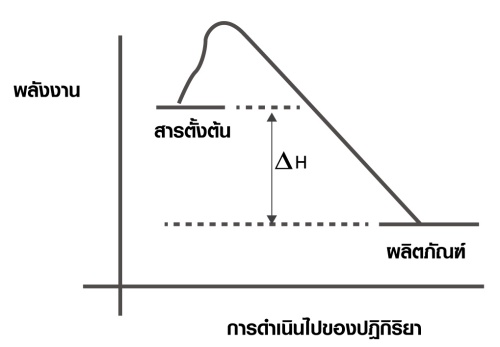
2. ปฏิกิริยาคายความร้อน (Exothermic reaction)
เป็นปฏิกิริยาที่ดูดพลังงานเข้าไปสลายพันธะ น้อยกว่าที่คายออกมาเพื่อสร้างพันธะ โดยในปฏิกิริยาคายความร้อนนี้ สารตั้งต้นจะมีพลังงานสูงกว่าผลิตภัณฑ์ จึงให้พลังงานความร้อนออกมาสู่สิ่งแวดล้อม ทำให้อุณหภูมิสูงขึ้น เมื่อเอามือสัมผัสภาชนะจะรู้สึกร้อน