จากคุณสมบัติเบื้องต้นของ ของแข็ง (Solid) ของเหลว (Liquid) และแก๊ส (Gas) เราได้รู้แล้วว่า สถานะของสาร (State of Matter) ทั้งสามสถานะมีคุณสมบัติสองอย่างที่เหมือนกัน คือ มีมวลและกินที่ ส่วนที่ต่างกันคือ การเปลี่ยนรูปร่างไปตามภาชนะและการเปลี่ยนแปลงปริมาตร โดยมีเพียงของแข็งที่ไม่เปลี่ยนแปลงรูปร่างไปตามภาชนะที่บรรจุ และมีเพียงแก๊สเท่านั้นที่เปลี่ยนแปลงปริมาตรไปตามขนาดของภาชนะได้ ซึ่งปัจจัยที่ทำให้คุณสมบัติของสารทั้งสามสถานะแตกต่างกันก็คือ การจัดเรียงตัวกันของอนุภาคในสารสถานะนั้น ๆ ซึ่ง อนุภาคนี้หมายถึงหน่วยย่อยที่เล็กมาก ๆ อย่างเช่น โมเลกุล หรืออะตอม
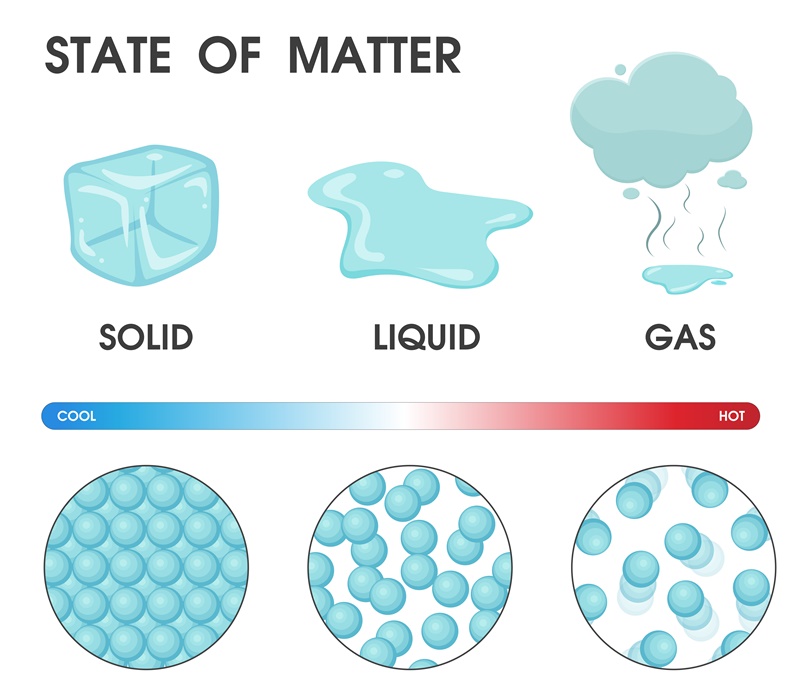
จากภาพจะเห็นได้ว่า อนุภาคของของแข็งอยู่ชิดติดกัน เรียงตัวกันเป็นระเบียบ มีแรงดึงดูดระหว่างอนุภาคมากที่สุด เคลื่อนไหวได้น้อย ของแข็งจึงรักษารูปทรงและปริมาตรไว้ได้ ไม่เปลี่ยนแปลงไปตามภาชนะ
ส่วนของเหลว อนุภาคจะอยู่ห่างกันมากกว่าในของแข็งเล็กน้อย ไม่เรียงตัวกัน แต่ละอนุภาคจึงเคลื่อนที่ไปมาได้ ทำให้ของเหลวเปลี่ยนรูปร่างได้ แต่ของเหลวก็ยังมีแรงดึงดูดระหว่างอนุภาคสูง จึงเกาะกลุ่มกันไม่ฟุ้งกระจายตัวอย่างอิสระ จึงทำให้ของเหลวมีปริมาตรที่แน่นอน
ทางด้านอนุภาคของแก๊สจะเห็นได้ว่า อนุภาคอยู่ห่างกัน กระจัดกระจายกันออกไป เคลื่อนที่ไปมาอย่างอิสระ จึงทำให้แก๊สแพร่ไปตามพื้นที่ว่างของภาชนะได้ทุกส่วน รูปร่างของแก๊สจึงเป็นไปตามภาชนะที่บรรจุ อนุภาคของแก๊สจะรักษาระยะห่างระหว่างกันให้เท่า ๆ กันเสมอ ในพื้นที่จำกัดถ้ามวลของแก๊สมีเพิ่มขึ้น ระยะห่างระหว่างอนุภาคก็จะลดลงหรือเบียดกันมากขึ้นนั่นเอง ปริมาตรของแก๊สจึงไม่แน่นอน หรือกล่าวได้ว่าแก๊สที่มีมวลต่างกัน เมื่อบรรจุในภาชนะแข็งแรงขนาดเดียวกันก็มีปริมาตรเท่ากันได้ ส่วนแก๊สที่มีมวลเท่ากันเมื่อบรรจุในภาชนะที่ขนาดต่างกัน ก็จะมีปริมาตรต่างกันนั่นเอง
จัดทำโดย มรุตเทพ วงษ์วาโย

