ดังที่ทราบกันอยู่แล้วว่า สารละลายนั้นประกอบด้วยตัวทำละลาย และตัวละลาย ในกระบวนการละลายของสารละลายนั้น เกี่ยวข้องกับพลังงานความร้อน พลังงานกับการละลายของสารทำให้เกิดปฏิกิริยาการดูดความร้อน หรือคายความร้อน

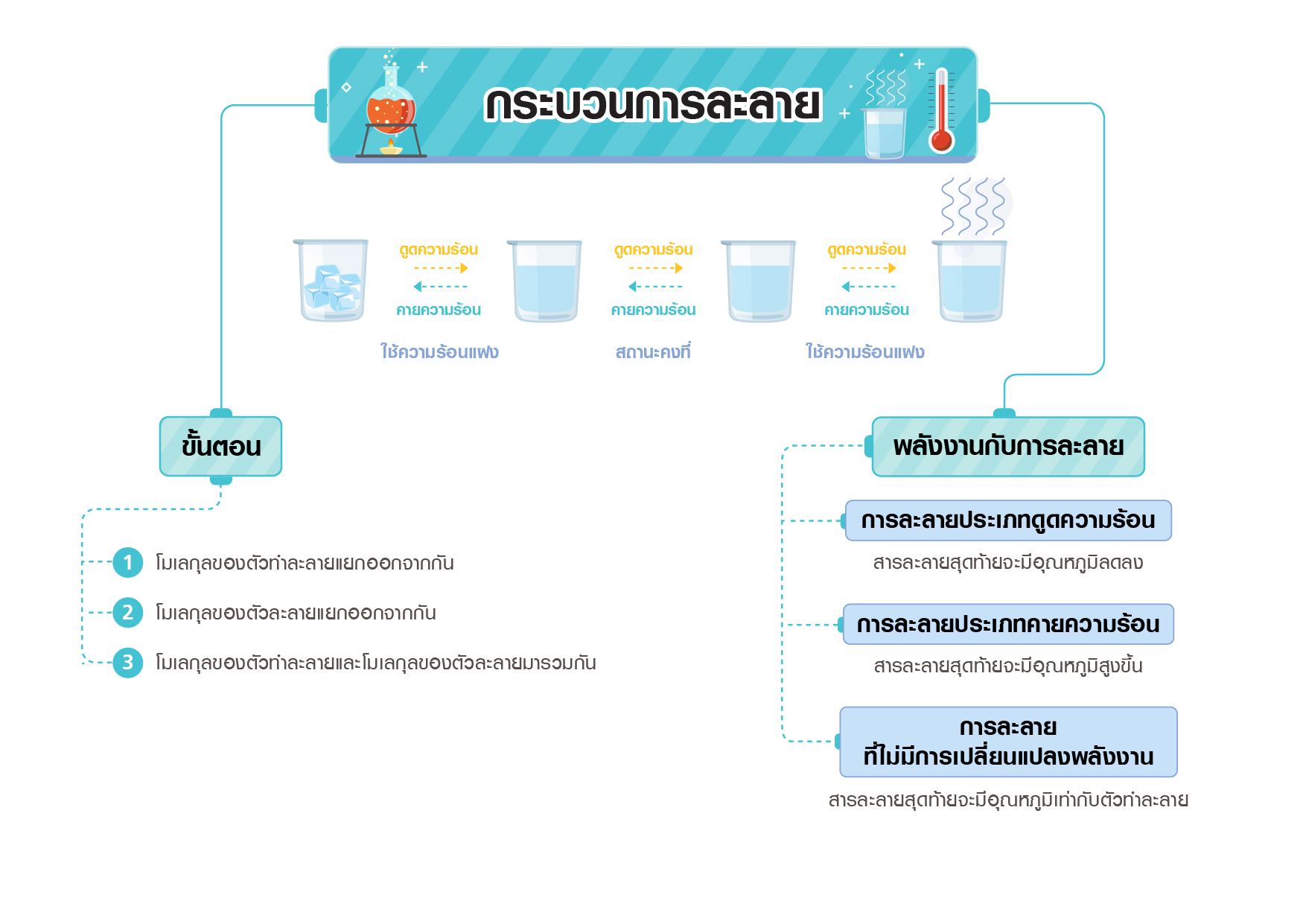
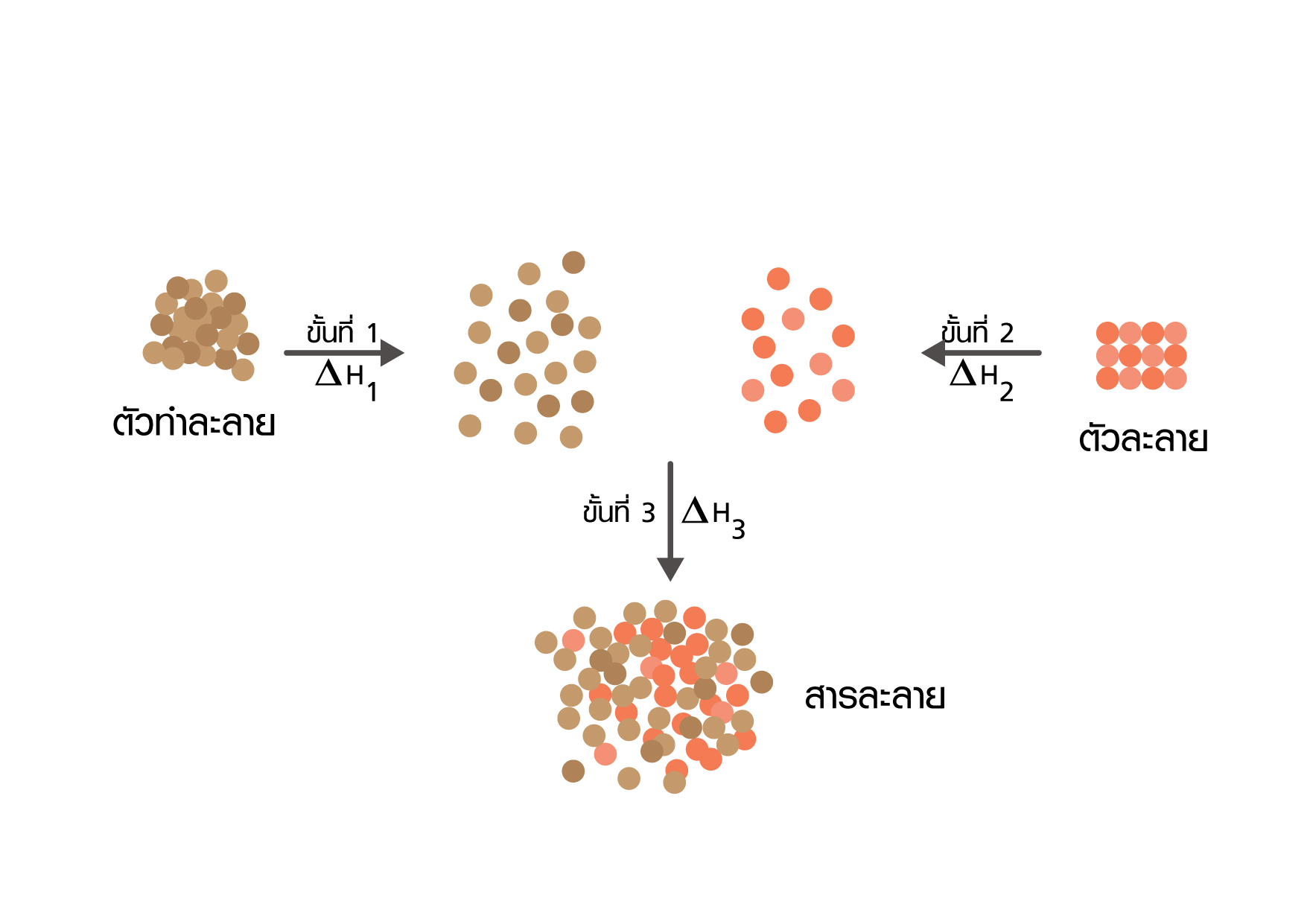
กระบวนการละลาย แบ่งเป็น 3 ขั้น ดังนี้
1. โมเลกุลของตัวทำละลายแยกออกจากกัน ต้องใช้พลังงานทำลายแรงดึงดูดระหว่างโมเลกุล (∆ H1)
2. โมเลกุลของตัวละลายแยกออกจากกัน ต้องใช้พลังงานทำลายแรงดึงดูดระหว่างโมเลกุล (∆H2)
3. โมเลกุลของตัวทำละลายและโมเลกุลของตัวละลายมารวมกัน มีการคายพลังงาน (∆H3)
พลังงานกับการละลายของสาร
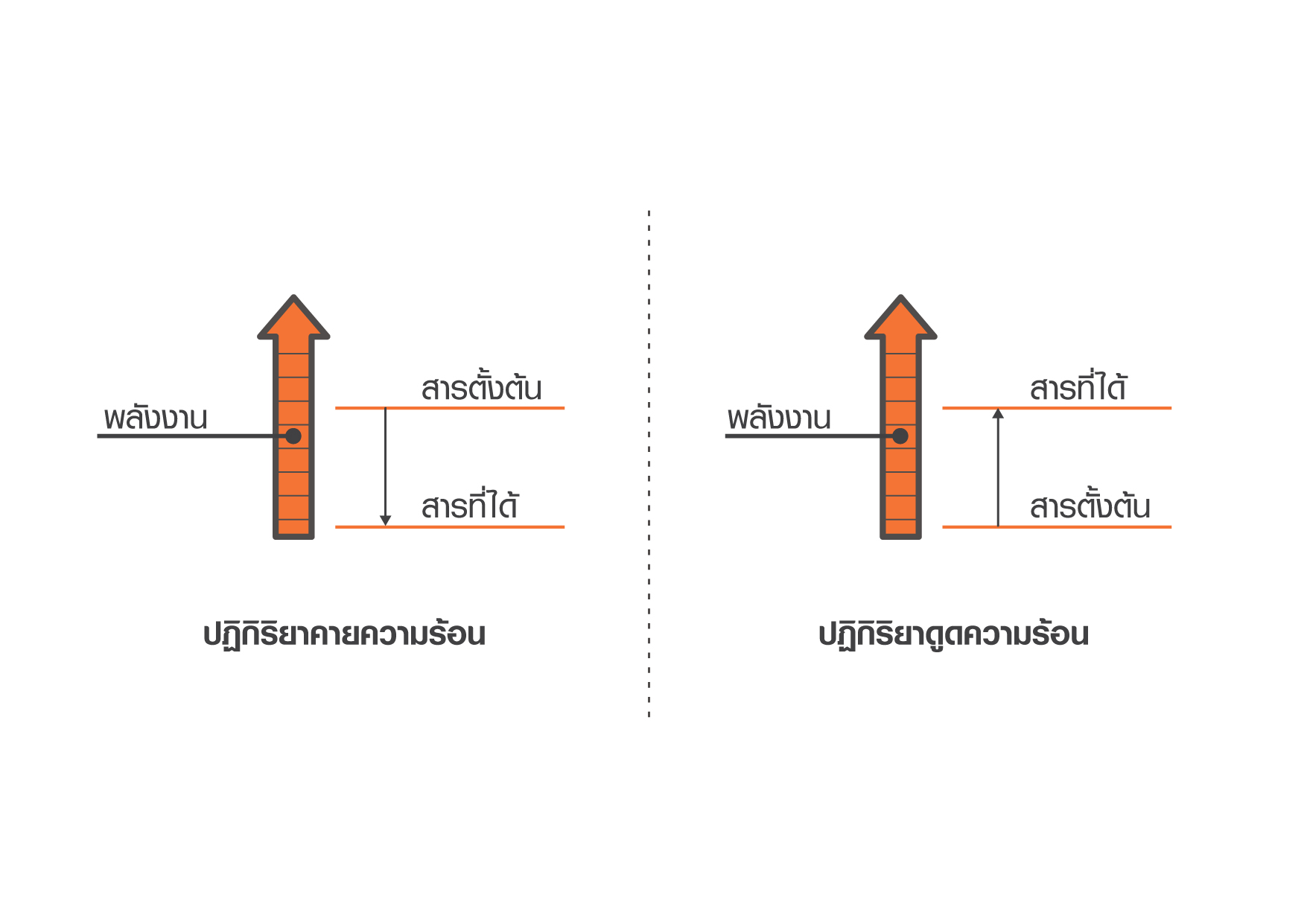
ถ้า ∆H3 มีค่ามากกว่า ∆H1 + ∆H2 กระบวนการนั้นถือเป็น การละลายประเภทคายความร้อน สารละลายสุดท้ายจะมีอุณหภูมิสูงขึ้น เช่น การละลายโซเดียมไฮดรอกไซด์ในน้ำ
ถ้า ∆H3 มีค่าน้อยกว่ากว่า ∆H1 + ∆H2 กระบวนการนั้นถือเป็น การละลายประเภทดูดความร้อน สารละลายสุดท้ายจะมีอุณหภูมิลดลง เช่น การละลายแอมโมเนียมคลอไรด์ในน้ำ
ถ้า ∆H3 = ∆H1 + ∆H2 ถือเป็นการละลายที่ไม่มีการเปลี่ยนแปลงพลังงาน สารละลายสุดท้ายจะมีอุณหภูมิเท่ากับอุณหภูมิเฉลี่ยของตัวทำละลายรวมกับตัวละลาย เช่น การละลายโซเดียมคลอไรด์ (เกลือแกง) ในน้ำ