
การเปลี่ยนสถานะของสาร เกี่ยวข้องกับแรงยึดเหนี่ยวระหว่างโมเลกุล ทำให้เกิดปรากฏการณ์ต่าง ๆ เช่น การหลอมเหลว การควบแน่น การระเหิด เป็นต้น นอกจากนี้ยังเป็นที่มาของสมบัติต่าง ๆ ของสาร เช่น จุดเดือด จุดหลอมเหลว จุดเยือกแข็ง เป็นต้น
เมื่อของแข็งได้รับความร้อน โมเลกุลของสารได้รับพลังงานเพิ่มขึ้น ทำให้แต่ละโมเลกุลมีพลังงานในตัวเองสูงขึ้นจนถึงระดับที่สามารถเอาชนะแรงดึงดูดระหว่างโมเลกุล ทำให้โมเลกุลสามารถเคลื่อนที่ได้เป็นอิสระเพิ่มขึ้น จึงเปลี่ยนสถานะจากของแข็งเป็นของเหลว อุณหภูมิที่ของแข็งเปลี่ยนเป็นของเหลวก็คือ จุดหลอมเหลว ของสารนั้น ๆ และหากให้ความร้อนแก่ของเหลวต่อไป พลังงานภายในโมเลกุลของของเหลวจะมีค่าเพิ่มขึ้นเรื่อย ๆ จนกระทั่งสามารถเอาชนะแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว โมเลกุลของของเหลวบางส่วนจึงเปลี่ยนสถานะกลายเป็นไอ เมื่อของเหลวได้รับพลังงานความร้อนขึ้น สัดส่วนของสารที่กลายเป็นไอก็จะมีมากขึ้นเรื่อย ๆ เมื่อความดันไอของสารมีค่าสูงเท่ากับความดันบรรยากาศ สารทั้งหมดเปลี่ยนสถานะจากของเหลวเป็นแก๊ส อุณหภูมิที่เกิดปรากฏการณ์ ดังกล่าวคือ จุดเดือดของสาร ถ้ายังให้ความร้อนแก่แก๊สต่อไปอีก แก๊สก็จะมีอุณหภูมิสูงขึ้นอีก
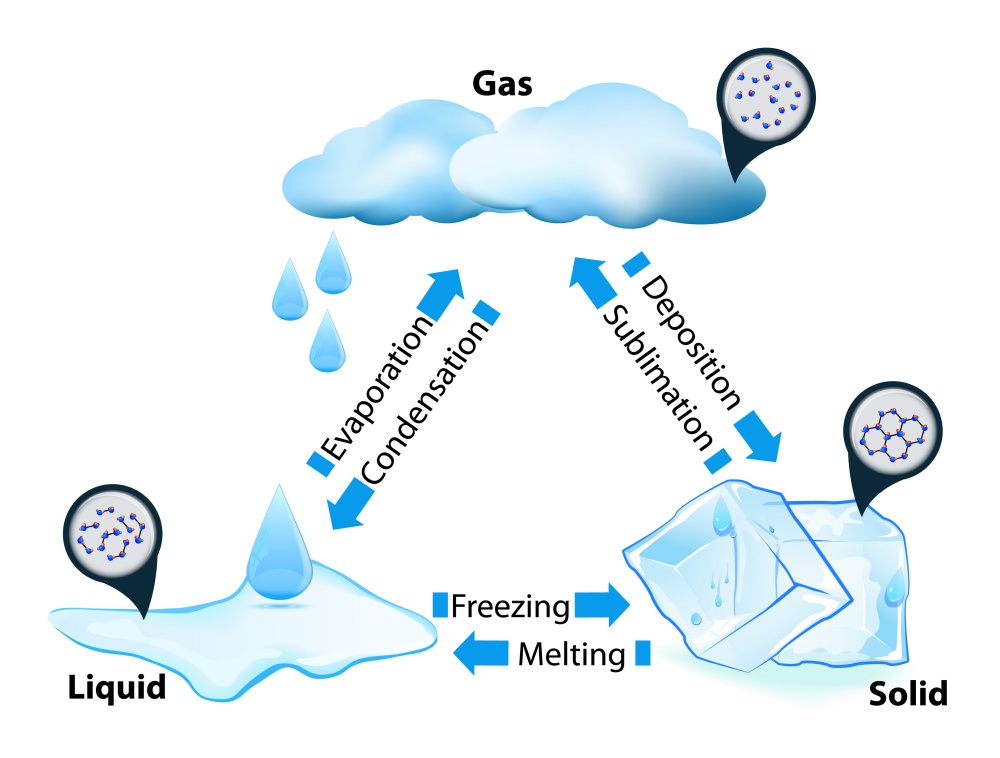
การเปลี่ยนแปลงสถานะของสารเป็นการเปลี่ยนแปลงทางกายภาพ มีหลายลักษณะดังนี้
- ของแข็งเปลี่ยนเป็นของเหลว เรียกว่า การหลอมเหลว (melting)
- ของเหลวเปลี่ยนเป็นแก๊ส เรียกว่า การกลายเป็นไอ (vaporization)
- แก๊สเปลี่ยนเป็นของเหลว เรียกว่า การควบแน่น (condensation)
- ของเหลวเปลี่ยนเป็นของแข็ง เรียกว่า การแข็งตัว (freezing)
- ของแข็งเปลี่ยนเป็นแก๊ส (โดยไม่เปลี่ยนเป็นของเหลวก่อน) เรียกว่า การระเหิด (sublimation)
- แก๊สเปลี่ยนเป็นของแข็ง เรียกว่า การระเหิดกลับ
จุดหลอมเหลว (melting point) คือ อุณหภูมิที่ของแข็งเปลี่ยนเป็นของเหลว
จุดเยือกแข็ง (freezing point) คือ อุณหภูมิที่ของเหลวเปลี่ยนเป็นของแข็ง
จุดเดือด (boiling point) คือ อุณหภูมิที่ของเหลวเปลี่ยนเป็นแก๊ส
จุดควบแน่น (condensation point) คือ อุณหภูมิที่แก๊สเปลี่ยนเป็นของเหลว
ในการเปลี่ยนสถานะของสาร ถ้าสารได้รับความร้อนจากสิ่งแวดล้อม เป็นการดูดความร้อน ถ้าสารสูญเสียความร้อนให้สิ่งแวดล้อมเป็นการคายความร้อน

การเปลี่ยนแปลงสถานะแบบคลายความร้อน

