

 55,292 Views
55,292 Views
ไนโตรเจนถูกค้นพบในปี ค.ศ. 1772 โดยแดเนียล รัทเทอร์ฟอร์ด (Daniel Rutherford) นักเคมี นักฟิสิกส์ และนักพฤกษศาสตร์ ชาวสก๊อตแลนด์ เขาทดลองโดยการนำหนูใส่ไว้ในที่ปิดสนิท หนูจะตายตามธรรมชาติ เมื่ออากาศเหลือน้อยลง จากนั้นเขาก็จุดเทียนใส่ลงไปในอากาศที่เหลือ เมื่อเปลวไฟดับลง เขาได้ทำการเผาฟอสฟอรัสชิ้นหนึ่งในภาชนะนั้น จากนั้นก็บังคับให้อากาศที่เหลือผ่านสารละลายที่ดูดซับก๊าซคาร์บอนไดออกไซด์ เป็นการกำจัดก๊าซออกซิเจนและคาร์บอนไดออกไซด์ออกจากส่วนประกอบของอากาศ และอากาศส่วนที่เหลือจากการกำจัดออกซิเจนและคาร์บอนไดออกไซด์ออกไปแล้วนี้จะไม่ช่วยในการเผาไหม้ รวมถึงไม่เอื้อต่อสิ่งมีชีวิตอย่างหนูทดลองให้มีชีวิตอยู่ได้ ซึ่งก๊าซที่เหลือนั้นก็คือ "ก๊าซไนโตรเจน" ที่เรารู้จักกันนั่นเอง
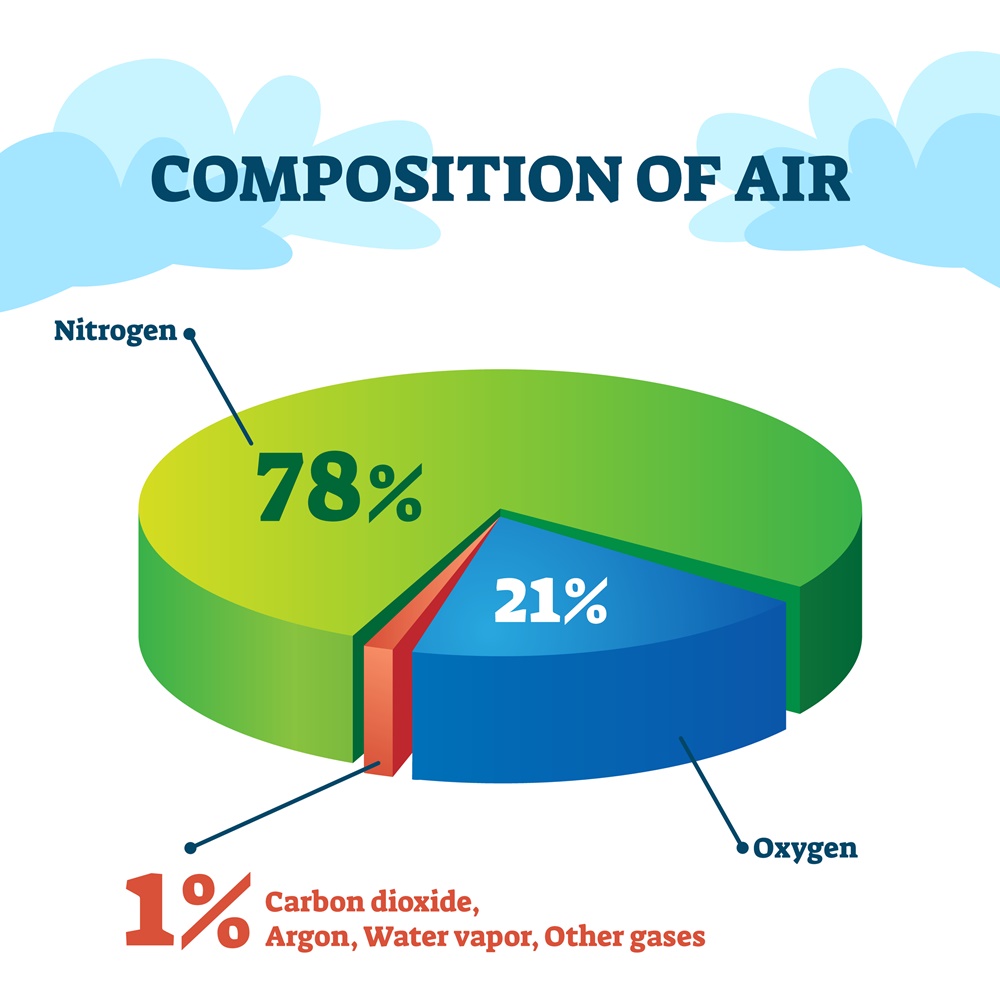
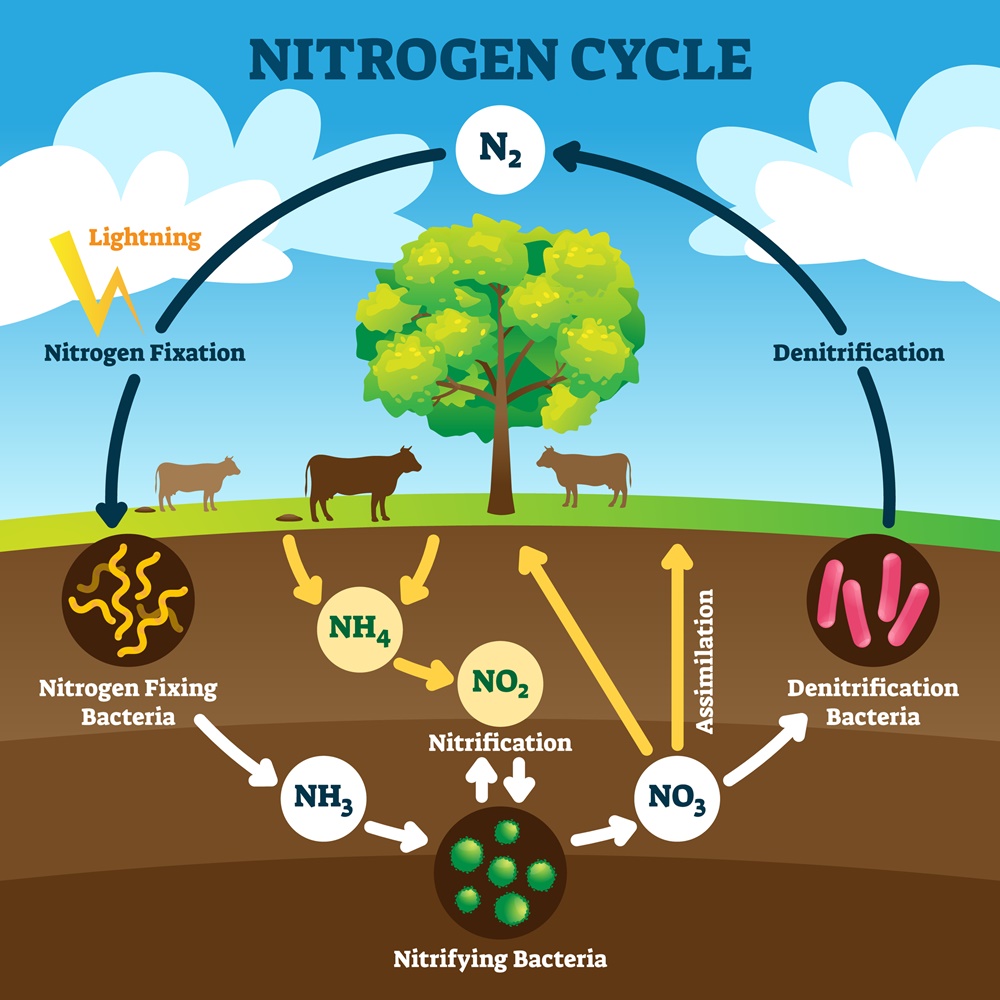
ไนโตรเจนมีความเสถียรมากในบรรยากาศและแทบจะไม่มีส่วนเกี่ยวข้องกับการเกิดปฏิกิริยาเคมีใด ๆ ในบรรยากาศเลย ดังนั้น ไนโตรเจนที่ถูกกักเก็บอยู่ในเศษซากดึกดำบรรพ์เมื่อครั้งเริ่มก่อตัวเป็นโลกในตอนแรก อาจจะไหลซึมออกมาตามรอยแตก รวมถึงการปะทุของภูเขาไฟ จากนั้นก็จะเข้าสู่วัฏจักรไนโตรเจน ซึ่งประกอบไปด้วย 4 ขั้นตอนหลัก ได้แก่ 1) nitrogen fixation 2) ammonification 3) nitrification 4) denitrification
การที่มีก๊าซไนโตรเจนปริมาณมากในอากาศ ไม่ได้หมายความรวมถึงปริมาณไนโตรเจนสถานะอื่น ๆ ทั้งโลก เพราะหากเปรียบเทียบกับปริมาณของออกซิเจนในสถานะอื่น ๆ ทั้งโลกรวมกันแล้ว จะกลายเป็นว่าไนโตรเจนนั้นมีปริมาณน้อยกว่าออกซิเจนอยู่หลายเท่าเลยทีเดียว แต่ด้วยความที่ก๊าซไนโตรเจนเป็นก๊าซที่ไม่ทำปฏิกิริยากับวัสดุที่เป็นของแข็งใด ๆ ระเหยได้ง่าย (จุดเดือดและจุดหลอมเหลวต่ำ) และมีความเสถียรเมื่อสัมผัสกับแสงอาทิตย์ จึงทำให้อยู่ในรูปของก๊าซในอากาศเป็นปริมาณมาก
การที่ไนโตรเจนไม่ได้ทำปฏิกิริยากับโมเลกุลอื่น ๆ ในบรรยากาศ และส่วนใหญ่อยู่ในอากาศในรูปแบบของก๊าซไนโตรเจนหรือ N2 การที่ไนโตรเจนไม่ทำปฏิกิริยากับโมเลกุลอื่น นั่นเกิดจากพันธะสามระหว่างที่มีความแข็งแรงมากในการใช้อิเล็กตรอนร่วมกัน 3 คู่ ของไนโตรเจน 2 อะตอม พันธะเหล่านี้มีรัศมีที่สั้น (Vanderwaals radius 0.092 nm) ซึ่งต้องการพลังงานจำนวนมากเพื่อที่จะทำลายพันธะของมัน ไนโตรเจนจะมีปฏิกิริยามากขึ้นที่อุณหภูมิสูงขึ้น ส่วนที่อุณหภูมิต่ำกว่า ตัวเร่งปฏิกิริยาบางชนิดทำให้ไนโตรเจนมีปฏิกิริยากับโมเลกุลอื่น ๆ ได้ โดยทั่วไปปฏิกิริยาที่เกิดขึ้นในบรรยากาศก็คือการเกิดไนโตรเจนออกไซด์ (NO) ระหว่างที่มีพายุและฟ้าผ่าลงมา (ทำให้เกิดไนเตรตกลับสู่พื้นดินในวัฏจักรไนโตรเจนได้)
- ไนโตรเจนเป็นธาตุที่ 7 บนตารางธาตุ มีเลขอะตอม ( Atomic number) คือ 7
- สัญลักษณ์บนตารางธาตุของไนโตรเจน คือ N
- มวลอะตอมโดยเฉลี่ย คือ 14.0067 u
- เมื่ออยู่ในรูปของแก๊สจะไม่มีสี ไม่มีกลิ่น และไม่มีรส โดยทั่วไปถือว่าเป็นก๊าซเฉื่อย ส่วนในรูปของของเหลว ไนโตรเจนจะไม่มีสี ไม่มีกลิ่น ไม่มีรสเช่นเดียวกัน และดูคล้ายกับน้ำ
- ที่อุณหภูมิห้องจะอยู่ในสถานะก๊าซ
- ความหนาแน่น 0.0012506 grams per cubic centimeter หรือ 1.25*10^-3 g.cm^-3
- จุดหลอมเหลว คือ -321 องศาฟาเรนไฮต์ หรือประมาณ -210 องศาเซลเซียส
- จุดเดือด คือ -320.42 องศาฟาเรนไฮต์ หรือประมาณ -195.79 องศาเซลเซียส
- ออกไซด์ของไนโตรเจนเป็นกรดแก่

ไนโตรเจนเป็นองค์ประกอบสำคัญของสิ่งมีชีวิต เพราะมันเป็นองค์ประกอบในกรดนิวคลีอิก 2 ชนิด คือ กรดดีออกซีไรโบนิวคลีอิก (DNA) ซึ่งเป็นสารพันธุกรรม เก็บข้อมูลทางพันธุกรรมของสิ่งมีชีวิต และกรดไรโบนิวคลีก(RNA) ทำหน้าที่ถ่ายทอดข้อมูลจาก DNA ไนโตรเจนยังเป็นองค์ประกอบของโปรตีน ฮอร์โมน และคลอโรฟิลล์ด้วย สำหรับสิ่งมีชีวิตต่าง ๆ หากได้รับไนโตรเจนไม่เพียงพอจะไม่สามารถสร้างกรดอะมิโน (ประกอบด้วยไนโตรเจนและไฮโดรเจน) ซึ่งเป็นวัตถุดิบนำไปสร้างเซลล์ กล้ามเนื้อ และเนื้อเยื่อต่อไปได้ ส่วนพืชจะนำไนโตรเจนที่อยู่ในรูปที่พืชสามารถนำไปใช้ได้ ไปเป็นวัตถุดิบในการสร้างเนื้อเยื่อ แต่หากได้รับไนโตรเจนไม่เพียงพอก็จะไม่สามารถเจริญเติบโต นำไปสู่ผลผลิตที่ต่ำ ดอกและผลเล็กกว่าปกติ อย่างไรก็ตามหากได้รับไนโตรเจนมากเกินไปก็จะเป็นพิษต่อทั้งพืช สิ่งมีชีวิตอื่น ๆ และเป็นอันตรายต่อสิ่งแวดล้อมได้เช่นกัน

บทความที่เกี่ยวข้อง
- วัฏจักรของสารในระบบนิเวศ
