

 4,675 Views
4,675 Views
โดยปัจจุบันมีบริษัทเวชภัณฑ์จำนวน 6 บริษัทที่สหภาพยุโรปได้จัดทำข้อตกลงซื้อวัคซีนแล้ว ได้แก่ บริษัท BioNTech-Pfizer บริษัท Moderna บริษัท AstraZeneca บริษัท Sanofi-GSK บริษัท Janssen Pharmaceutica NV และบริษัท CureVac ซึ่งวัคซีนที่ถูกพัฒนาขึ้นจากบริษัทเหล่านี้ส่วนใหญ่ได้ผ่านการทดลองทางคลินิกขั้นที่ 3 แล้วและคาดว่าจะมีการเริ่มฉีดวัคซีนจากบางบริษัท เช่น BioNTech-Pfizer และ Moderna ในสหภาพยุโรปได้ตั้งแต่เดือนมกราคม 2564 หลังจากได้รับการอนุมัติจากองค์การยาแห่งสหภาพยุโรป (European Medicines Agency, EMA)ในเดือนธันวาคม 2563 โดยวัคซีนจากทั้ง 6 บริษัทมีความแตกต่างกันด้านเทคโนโลยีและนวัตกรรมที่นำมาใช้ในการพัฒนาวัคซีน ซึ่งสามารถสรุปได้ดังนี้
บริษัท Pfizer-BioNTech
บริษัท Pfizer จากสหรัฐอเมริกา ได้ร่วมกับบริษัท BioNTech จากประเทศเยอรมนีได้พัฒนาวัคซีนที่ชื่อว่า BNT162b2 ซึ่งเป็นวัคซีนที่ถูกผลิตขึ้นด้วยเทคโนโลยี mRNA ในรูปแบบ nucleoside-modified mRNALNP โดยมีการนำ mRNA ของไวรัส SARS-CoV-2 มาดัดแปลงและทำให้บริสุทธิ์ และนำมาห่อหุ้มด้วยอนุภาคนาโนไขมัน (lipid nanoparticle) โดยสรุป วัคซีนชนิดนี้จะประกอบไปด้วยองค์ประกอบสำคัญ 2 ส่วน คือ 1) mRNA (messenger RNA) ที่จำเพาะต่อโปรตีนหนามของเชื้อไวรัส SAR-CoV-2 ซึ่งโปรตีนดังกล่าวนี้มีความสำคัญในการเข้าสู่เซลล์ของระบบทางเดินหายใจ โดยปกติ mRNA มีหน้าที่เป็นแม่พิมพ์ในการสร้างโปรตีน หรือนำข้อมูลทางพันธุกรรมจาก DNA ไปใช้ในการสร้างโปรตีนที่มีความสำคัญ และ 2) อนุภาคนาโนไขมัน (lipid nanoparticle) ที่ใช้ห่อหุ้ม mRNA ซึ่งจะช่วยป้องกันไม่ให้ mRNA ถูกย่อยสลายจากเอนไซม์ไรโบนิวคลิเอสซึ่งมีอยู่ทั่วร่างกาย
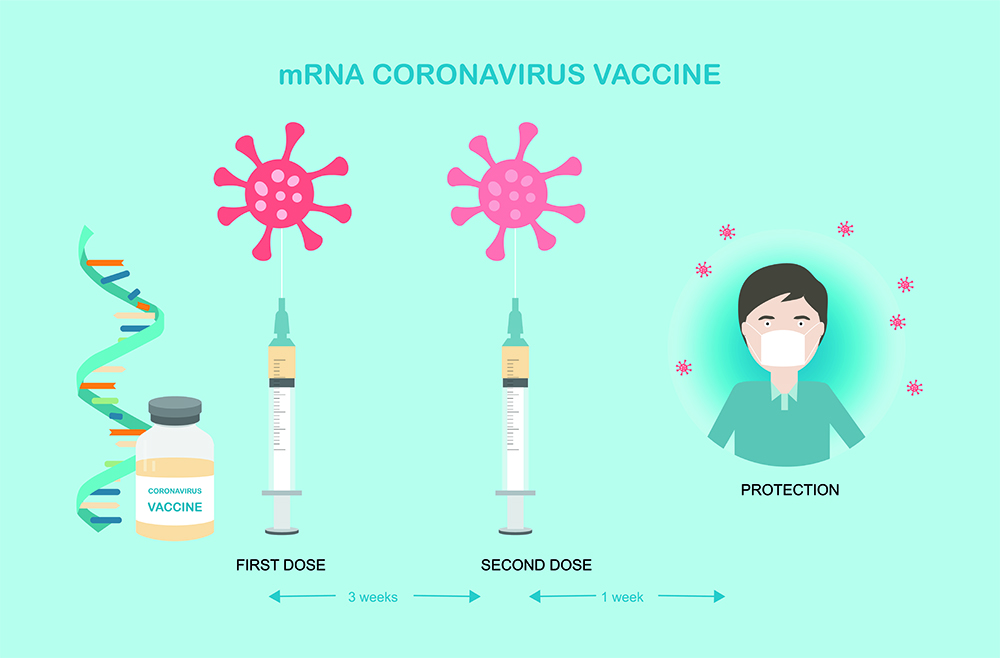
หลังจากที่ได้ฉีดวัคซีน BNT162b2 เข้าไปในร่างกายแล้ว mRNA ซึ่งเป็นชิ้นส่วนของพันธุกรรมที่ไม่ก่อให้เกิดโรคแทรกซ้อนจะถูกถอดรหัสและนำไปสร้างเป็นโปรตีนที่มีลักษณะเหมือนกับโปรตีนบนหนามของไวรัส ซึ่งโปรตีนนี้จะเข้าไปกระตุ้นให้ระบบภูมิคุ้มกันของร่างกายสร้างแอนติบอดี้ที่ใช้ในการต่อสู้กับเชื้อไวรัส SARS-CoV-2 ซึ่งเป็นสาเหตุของการเกิดโรคโควิด-19 ทั้งนี้ ข้อดีของการใช้เทคโนโลยีชนิดนี้ในการพัฒนาวัคซีน คือ สามารถลดขั้นตอนและระยะเวลาจากเดิมได้มาก เพราะการสร้างวัคซีนแบบเก่าจะต้องเพาะเชื้อไวรัสก่อนแล้วทำให้เชื้อนั้นอ่อนแอ ซึ่งถือว่ามีความเสี่ยงที่สูงกว่าและใช้ระยะเวลามากกว่า
นอกจากนี้ mRNA จะสร้างแต่โปรตีนของไวรัส ไม่ได้เป็นสารพันธุกรรมทั้งเส้นของไวรัส ดังนั้นจึงไม่มีโอกาสที่จะสร้างอนุภาคไวรัสที่ติดเชื้อต่อไปได้ ความปลอดภัยของวัคซีนจึงเทียบเท่ากับวัคซีนอื่น ๆ ที่ใช้โปรตีนเป็นแอนติเจน แต่ mRNA อาจจะไปกระตุ้นการสร้างสารจำพวกอินเตอร์เฟียรอน ( Interferon) ซึ่งเป็นสารโปรตีนที่ถูกหลั่งออกมาจากเซลส์ของสัตว์และมนุษย์เพื่อเป็นการตอบสนองต่อสิ่งแปลกปลอมต่างๆ เช่น ไวรัส แบคทีเรีย ที่เข้าสู่ร่างกาย โดยสารอินเตอร์เฟียรอนที่เกิดขึ้นในร่างกายดังกล่าวอาจจะมีผลข้างเคียงอื่น ๆ ได้บ้าง
สำหรับวัคซีน BNT162 b2 จากบริษัท PfizerBioNTech ถือว่ามีจุดเด่น 2 ประการ คือ 1) จากผลการทดลองทางคลินิกพบว่ามีประสิทธิภาพในการยับยั้งการทำงานของไวรัสได้ดีถึงร้อยละ 95 และ 2) สามารถผลิตได้ในจำนวนมากในเวลาไม่นาน แต่ยังมีข้อกังวลในประเด็นที่ว่า mRNA เสียสภาพได้ง่าย ดังนั้นจึงมีความจำเป็นในการจัดเก็บวัคซีน ณ อุณหภูมิที่ต่ำมาก ๆ โดยต้องจัดเก็บ ณ อุณหภูมิ -70 องศาเซลเซียส รวมไปถึงก่อนฉีดวัคซีนให้ผู้ป่วยจำเป็นต้องมีขั้นตอนการละลายและปรับอุณหภูมิของวัคซีน พร้อมทั้งมีการทำให้เจือจาง นอกจากนี้ ยังพบผลข้างเคียงจากการฉีดวัคซีนชนิดนี้แต่ถือว่าเป็นอาการที่ไม่รุนแรงซึ่งพบได้ทั่วไปจากการฉีดวัคซีน
บริษัท Moderna
บริษัท Moderna จากสหรัฐอเมริกาได้พัฒนาวัคซีนที่ชื่อว่า mRNA-1273 โดยใช้นำ mRNA ของไวรัส SARS-CoV-2 มาดัดแปลงและบรรจุในอนุภาคนาโนไขมัน (lipid nanoparticle) เพื่อพัฒนาเป็นวัคซีนเช่นเดียวกับ บริษัท Pfizer-BioNTech แต่มีใช้ mRNA ในปริมาณสูงกว่า และวัคซีนของบริษัท Moderna มีความคงสภาพที่อุณหภูมิ -20 องศาเซลเซียส
บริษัท CureVac
บริษัท CureVac เป็นบริษัทสัญชาติเยอรมันตั้งอยู่ ณ เมือง Tübingen ได้พัฒนาวัคซีนสำหรับโรคโควิด-19 โดยใช้เทคโนโลยีเดียวกับบริษัท Pfizer-BioNTech และบริษัท Moderna นั่นคือการใช้ mRNA ห่อหุ้มด้วยอนุภาคนาโนไขมัน (lipid nanoparticle)
บริษัท Sanofi-GSK
บริษัท Sanofi-GSK ซึ่งเป็นการร่วมมือพัฒนาวัคซีนระหว่าง 2 บริษัท คือ บริษัท Sanofi จากฝรั่งเศส และบริษัท GSK จากสหราชอาณาจักร ได้ร่วมแบ่งปันเทคโนโลยีเพื่อผลิตวัคซีนป้องกันโรคโควิด โดยบริษัท Sanofi ได้ใช้เทคโนโลยีการตัดต่อดีเอ็นเอสายผสม (recombinant DNA) ซึ่งเป็นการนำโมเลกุลดีเอ็นเอจากสิ่งมีชีวิตที่มีสายพันธุ์แตกต่างกันมาเชื่อมต่อกันเป็นดีเอ็นเอสายเดียวกัน จากนั้นนำมาพัฒนาโปรตีนแอนติเจนที่ชื่อว่า S-protein COVID-19 antigen ซึ่งใช้เป็นสารตั้งต้นในวัคซีน ซึ่งวิธีนี้จะสามารถผลิตสารพันธุกรรมที่ตรงกับโปรตีนบนพื้นผิวของไวรัสอย่างแม่นยำ และสามารถนำมาผลิตเป็นวัคซีนได้อย่างถูกต้องและรวดเร็ว
ในขณะที่บริษัท GSK ได้พัฒนานวัตกรรมของระบบสารเสริมฤทธิ์ประเภทต่าง ๆ โดยสารเสริมฤทธิ์ เป็นสารประกอบที่ใส่ลงในวัคซีนบางชนิดเพื่อเพิ่มประสิทธิภาพการตอบสนองของภูมิคุ้มกัน ทำให้ภูมิคุ้มกันมีความแข็งแรงและออกฤทธิ์นานกว่าเดิมเพื่อให้ร่างกายสามารถต่อสู้กับการติดเชื้อต่าง ๆ ได้ดีกว่าการใช้วัคซีนเพียงอย่างเดียว การใช้สารเสริมฤทธิ์จึงมีความสำคัญอย่างยิ่งต่อสถานการณ์การแพร่ระบาดของโรค เพราะช่วยลดปริมาณของแอนติเจนที่ต้องผสมลงในวัคซีน ช่วยให้ผลิตวัคซีนได้เพิ่มขึ้น และทำให้สามารถเข้าถึงผู้คนได้มากขึ้น ซึ่งเทคโนโลยีสารเสริมฤทธิ์นี้เคยถูกนำมาใช้ในการจัดการสถานการณ์การแพร่ระบาดของไข้หวัดใหญ่จนเป็นผลสำเร็จมาแล้ว
บริษัท Johnson & Johnson
วัคซีนที่บริษัท Johnson & Johnson ทำการทดลองและพัฒนามีชื่อว่า Ad26.COV2.S โดยวัคซีนดังกล่าวได้ใช้อะดิโนไว รัสเซโรไทป์ 26 ( Ad26) เป็นตัวเหนี่ยวน า ซึ่งสามารถก่อให้เกิดปฏิกิริยาตอบสนองทางภูมิคุ้มกันที่แข็งแกร่ง โดยสร้างแอนติบอดีที่มีฤทธิ์ลบล้าง ซึ่งสามารถป้องกันการติดเชื้อและสร้างภูมิคุ้มกันจากไวรัสในปอดอย่างสมบูรณ์
บริษัท AstraZeneca และมหาวิทยาลัย Oxford
บริษัท AstraZeneca (กลุ่มบริษัทยาสวีเดน-สหราชอาณาจักร) และมหาวิทยาลัย Oxford ได้พัฒนาวัคซีนที่ชื่อว่า ChAdOx1 nCoV-19 ซึ่งเป็นวัคซีนที่พัฒนาขึ้นจากเชื้ออะดิโนไวรัสที่ก่อให้เกิดโรคหวัดในชิมแปนซี ที่ถูกนำมาดัดแปลงพันธุกรรมจนไม่สามารถก่อให้เกิดการติดเชื้อในมนุษย์ได้ และทำให้มีลักษณะคล้ายเชื้อไวรัสโคโรนาสายพันธุ์ใหม่
นอกจากนี้วัคซีนจากทั้ง 6 บริษัทยังมีความแตกต่างในประเด็นประสิทธิภาพการทำงาน จำนวนโดสที่ฉีด อุณหภูมิการจัดเก็บ และราคา ซึ่งสามารถสรุปได้ดังนี้
| PfizerBioNTech | Moderna | AstraZeneca และ มหาวิทยาลัย Oxford | CureVac | Sanofi-GSK | Johnson & Johnson | |
| ชนิดวัคซีน | mRNA | mRNA | อะดิโนไวรัสที่ก่อให้เกิดโรคหวัดในชิมแปนซี | mRNA | S-protein COVID-19 antigen ที่ได้จากการตัดต่อดีเอ็นเอสายผสม (recombinant DNA) และการใช้สารเสริมฤทธิ์ | อะดิโนไวรัส เซโรไทป์ 26 (Ad26) |
| สถานะการทดสอบทางคลินิกกับมนุษย์ | ขั้นที่ 3 | ขั้นที่ 3 | ขั้นที่ 3 | ขั้นที่ 3 (สิ้นสุดในปลายปี 2563) | ขั้นที่ 1/2 | ขั้นที่ 3 |
| ประสิทธิภาพการต้านไวรัส | 95% | 94.5% | 70% | ยังไม่มีการเผยแพร่ผลการทดสอบอย่างเป็นทางการ | ยังไม่มีการเผยแพร่ผลการทดสอบอย่างเป็นทางการ | ยังไม่มีการเผยแพร่ผลการทดสอบอย่างเป็นทางการ |
| จำนวนโดสที่ต้องฉีด/คน | 2 โดส | 2 โดส | 2 โดส | 1 หรือ 2 โดส | 1 หรือ 2 โดส | 1 หรือ 2 โดส |
| อุณหภูมิการจัดเก็บ | -70 °C แต่เก็บภายใต้อุณหภูมิ 2-8 °C ได้เป็นเวลาแค่ 5 วัน | -20 °C นาน 6 เดือน หรือ อุณหภูมิ 2-8 °C ได้เป็นเวลา 30 วัน | อุณหภูมิ 2-8 ° C ได้เป็นเวลา 6 เดือน | อุณหภูมิ 2-8 ° C ได้เป็นเวลา 3 เดือน | อุณหภูมิ 2-8 ° C | อุณหภูมิ 2-8 ° C |
| ราคาต่อโดส | 12 ยูโร | 20-30 ยูโร | 3 ยูโร | 10 ยูโร | 8 ยูโร | 7 ยูโร |
| จำนวนโดสที่สั่งซื้อโดยสหภาพยุโรป | 200 ล้านชุด (แผนซื้อ เพิ่มเติมอีก 100 ล้านชุด) | 80 ล้านชุด (แผนซื้อ เพิ่มเติมอีก 80 ล้านชุด) | 300 ล้านชุด (แผนซื้อ เพิ่มเติมอีก 100 ล้านชุด) | 225 ล้านชุด (แผนซื้อ เพิ่มเติมอีก 180 ล้านชุด) | 300 ล้านชุด | 200 ล้านชุด (แผนซื้อ เพิ่มเติมอีก 200 ล้านชุด) |
ณ ปัจจุบัน จากทั้งหมด 6 บริษัทที่สหภาพยุโรปได้ทำการข้อตกลงซื้อขายวัคซีน มีเพียงแค่ 2 คือ บริษัท Pfizer-BioNTech และ บริษัท Moderna ที่ได้ยื่นขออนุมัติวัคซีนเพื่อให้ใช้ในกรณีฉุกเฉินกับองค์การยาแห่งสหภาพ ยุโรป (European Medicines Agency - EMA) เป็นที่เรียบร้อยแล้ว โดยเมื่อวันที่ 21 ธันวาคม2563 วัคซีนของบริษัท Pfizer-BioNTech ได้รับอนุมัติจากการประเมินโดยองค์การยาแห่งสหภาพยุโรป (EMA) เรียบร้อยแล้ว ซึ่งจะเป็นวัคซีนชนิดแรกที่จะใช้ในยุโรป โดยจะเริ่มมีการฉีดวัคซีนของบริษัท PfizerBioNTech ทั่วสหภาพยุโรปพร้อมกันได้ตั้งแต่ในช่วงวันที่ 27-29 เดือน ธันวาคม 2563 โดยบริษัท BioNTech สัญชาติเยอรมนีได้รับงบสนับสนุนส่วนหนึ่งจากสหภาพยุโรปในการวิจัยและพัฒนาวัคซีนป้องกันโควิด-19 นอกจากนี้บริษัท Pfizer-BioNTech ยังได้รับการอนุมัติจากทางรัฐบาลสหราชอาณาจักรไปเรียบร้อยแล้ว และเริ่มมีการฉีดวัคซีนให้แก่ประชาชนในรัฐบาลสหราชอาณาจักรแล้วตั้งแต่ช่วงต้นเดือนธันวาคม 2563 โดย วัคซีนได้มาจากโรงงานของบริษัท PfizerBioNTech ที่ตั้งอยู่ในเมือง Puurs ประเทศเบลเยียม แต่ยังมีข้อกังวลเกี่ยวกับระยะเวลาการขนส่งวัคซีนโดยรถบรรทุก เนื่องจากหลังจากวันที่ 31 ธันวาคม 2563 สหราชอาณาจักรจะออกจากสหภาพยุโรปอย่างเป็นทางการ ทำให้ต้องมีการตรวจสินค้าที่ผ่านเข้าออกชายแดนระหว่างเบลเยียมและสหราชอาณาจักร จึงจะทำให้เกิดการจราจรติดขัดและอาจจะต้องเสียเวลานานในการรอ ด้วยเหตุนี้บริษัท Pfizer-BioNTech จึงมีแผนที่จะขนส่งวัคซีนโดยเครื่องบินไปยังสหราชอาณาจักร
ในขณะที่วัคซีนของบริษัท Moderna ได้รับอนุมัติจากทางรัฐบาลสหราชอาณาจักรและจากการประเมินโดยองค์การยาแห่งสหภาพยุโรป (EMA) เมื่อต้นเดือน มกราคม 2654 และเริ่มมีการฉีดวัคซีนให้แก่ประชาชนในเดือนมกราคม 2564
สำหรับการฉีดวัคซีนให้แก่ประชาชน หลาย ๆ ประเทศในยุโรปมีการประกาศแผนการฉีดวัคซีนมาแล้วว่าจะให้สิทธิแก่ผู้อาศัยและเจ้าหน้าที่ในบ้านพักคนชรา รวมทั้งอาสาสมัครและเจ้าหน้าที่ที่สัมผัสกับบุคคลดังกล่าว ซึ่งได้แก่ เจ้าหน้าที่ในโรงพยาบาลแพทย์ พยาบาล เจ้าหน้าที่ด้านสาธารณสุขและที่ทำงานเกี่ยวกับครอบครัวและสังคม (อาจรวมถึงครูด้วย) บุคคลอายุ 65 ปีขึ้นไป และบุคคลอายุระหว่าง 45-65 ปีที่มีโรคประจำตัว ตามลำดับ ถัดมาจะเป็นผู้ที่มีอาชีพที่มีความจำเป็นต่อการรักษาความสงบเรียบร้อยและปลอดภัย (เช่น ตำรวจ พนักงานดับเพลิง พนักงานทำความสะอาดหรือเก็บขยะ เป็นต้น) โดยมีการตั้งเป้าไว้ว่าร้อยละ 70 ของประชากรจะต้องได้รับการฉีดวัคซีนภายในฤดูร้อน (กรกฎาคม-สิงหาคม) ปี 2564
หลังจากมีการฉีดวัคซีนของบริษัท Pfizer-BioNTech ให้กับชาวอังกฤษเป็นรายแรกของโลก ต่อมาในวันที่ 8 ธันวาคม 2563 บริษัท Pfizer-BioNTech ได้มีการเผยแพร่รายงานซึ่งมีข้อมูลว่าด้วยเรื่องประสิทธิภาพและผลข้างเคียงของการฉีดวัคซีนรวมอยู่ด้วย โดยในรายงานระบุว่าประสิทธิภาพของวัคซีนมีความแตกต่างเพียงเล็กน้อยตามอายุและชาติพันธุ์ โดยพบว่าประสิทธิภาพของวัคซีนในกลุ่มคนผิวดำสูงถึงร้อยละ 100 ขณะที่ในกลุ่มผู้สูงอายุมากกว่า 55 ปี ประสิทธิภาพของวัคซีนอยู่ที่ร้อยละ 94 และกลุ่มที่มีโรคประจำตัว ประสิทธิภาพของวัคซีนอยู่ที่ร้อยละ 95 เป็นต้น
ในประเด็นผลข้างเคียงจากการฉีดวัคซีนพบว่า อาการที่เกิดขึ้นอยู่ในระดับปานกลางและไม่รุนแรง โดยส่วนใหญ่กลุ่มอาการที่พบ ได้แก่ ความเจ็บปวด ณ บริเวณที่ถูกฉีดยา (ร้อยละ 84) อาการง่วงและอ่อนเพลีย (ร้อยละ 63) ปวดหัว (ร้อยละ 55) อาการหนาวสั่น (ร้อยละ 32) อาการปวดตามข้อต่อ (ร้อยละ 24) และมีไข้ (ร้อยละ 14) เป็นต้น โดยอาการเหล่านี้จะหายไปเองในเวลา 1-2 วัน นอกจากนี้ยังพบว่ามีผู้ป่วย 4 รายที่ได้รับวัคซีนที่มีอาการอัมพาตในกล้ามเนื้อบางส่วนของใบหน้า ซึ่งอยู่ในระหว่างการตรวจสอบว่ามีสาเหตุมาจากวัคซีนหรือไม่ และในรายงานได้บ่งชี้ว่าผู้สูงอายุมีโอกาสได้รับผลข้างเคียงจากวัคซีนน้อยกว่าผู้ที่มีอายุน้อยกว่า โดยเบื้องต้นผู้เชี่ยวชาญบางท่านคิดว่าการพบผลข้างเคียงในระดับที่ไม่รุนแรงถือเป็นสัญญาณที่ดีเพราะผลข้างเคียงดังกล่าวอาจแสดงให้เห็นว่าวัคซีนนั้นกำลังทำงานและออกฤทธิ์ได้จริง
นอกจากนี้ยังพบว่ามีผู้ที่ได้รับวัคซีนของบริษัท PfizerBioNTech ในสหราชอาณาจักร เกิดอาการแพ้เป็นจำนวน 2 ราย แต่ได้หายเป็นปกติแล้ว ซึ่งสันนิษฐานว่าอาจมีสารบางอย่างในวัคซีนที่ทำหน้าที่เป็นสารก่อภูมิแพ้ในกลุ่มบุคคลที่มีอาการแพ้ยาหรืออาหารบางประเภท โดยทั่วไปอาการของการแพ้วัคซีนจะประกอบด้วย การเกิดผื่นคันที่ผิวหนัง มีอาการหายใจถี่และใบหน้าหรือลิ้นบวม ด้วยเหตุนี้องค์กรกำกับดูแลยาและผลิตภัณฑ์สุขภาพของสหราชอาณาจักร (Medicines and Healthcare products Regulatory Agency, MHRA) จึงได้ออกประกาศแนวทางการฉีดวัคซีนฉบับใหม่ให้แก่บุคลากรทางการแพทย์ โดยมีคำแนะนำว่าผู้ที่มีประวัติแพ้วัคซีน ยา หรืออาหารแล้วมีอาการตอบสนองรุนแรง หรือผู้ได้รับคำแนะนำจากแพทย์ให้ใช้เครื่องฉีดอะดรีนาลีนแบบพกพา ไม่ควรได้รับวัคซีนของบริษัท Pfizer-BioNTech เพราะมีความเสี่ยงที่จะเกิดอาการแพ้ชนิดรุนแรงได้
บริษัท Pfizer-BioNTech มีแผนที่จะศึกษาและติดตามอาการของผู้ที่ได้รับวัคซีนเป็นเวลา 2 ปี เพื่อประเมินถึงผลข้างเคียงและประสิทธิภาพของวัคซีน ว่าสามารถป้องกันผู้ที่ได้รับวัคซีนจากการติดเชื้อไวรัส SARS-CoV2 ได้เป็นระยะเวลานานเท่าใด และจำเป็นต้องฉีดวัคซีนซ้ำ ณ เวลาไหน
ที่มา:
https://www.fiercepharma.com/pharma/despite-pfizer-s-high-efficacy-expectations-other-covid-vaccines-may-have-a-logistics-edge
https://ec.europa.eu/commission/presscorner/detail/en/ip_20_2200
https://www.biospace.com/article/comparing-covid-19-vaccines-pfizer-biontech-moderna-astrazeneca-oxford-j-and-j-russia-s-sputnik-v/
https://www.vrt.be/vrtnws/nl/
https://ec.europa.eu/info/sites/info/files/research_and_innovation/research_by_area/documents/ec_rtd_cv-projects.pdf
https://www.wsj.com/articles/takeaways-from-the-pfizer-biontech-vaccine-reports11607449550
จากวารสารข่าววิทยาศาสตร์และเทคโนโลยีจากกรุงบรัสเซลส์ ฉบับที่ 12 ประจำเดือน ธันวาคม 2563
