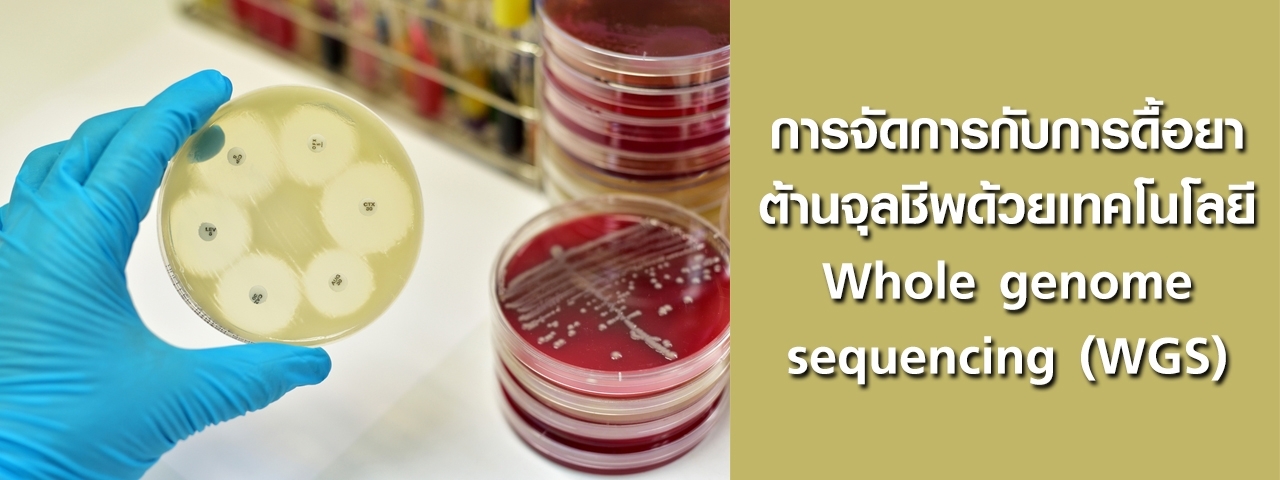

 11,664 Views
11,664 Views
การค้นพบยาปฏิชีวนะถือเป็นความสำเร็จที่ยิ่งใหญ่สำหรับมวลมนุษยชาติ เพราะสามารถช่วยชีวิตของคนนับล้านที่ป่วยจากการติดเชื้อแบคทีเรียให้หายได้ แต่ปัจจุบันประสิทธิภาพของยาปฏิชีวนะได้ลดลงอย่างมาก เนื่องจากเชื้อจุลินทรีย์ที่ก่อให้เกิดโรคมีการปรับตัวให้ดื้อต่อยา ส่งผลให้ประสิทธิภาพของยาปฏิชีวนะที่มีในปัจจุบันลดลง และอาจไม่มีประสิทธิภาพในการรักษาอีกต่อไปในอนาคต ดังนั้นจึงเป็นที่มาของคำว่า “การดื้อยาต้านจุลชีพ (Antimicrobial Resistance, AMR)” ซึ่งถูกนิยามไว้ว่า “ความสามารถของจุลินทรีย์ (เช่น แบคทีเรีย ไวรัส และรา) ในการเจริญเติบโตหรืออยู่รอดได้แม้สัมผัสกับยาฆ่าเชื้อ (หรือ ยาต้านจุลชีพ) ที่มีความเข้มข้นเพียงพอในการฆ่าหรือยับยั้งจุลินทรีย์ในสายพันธุ์เดียวกัน หรือความสามารถของจุลินทรีย์ในการเจริญเติบโตหรืออยู่รอดได้ในสภาวะที่มีความเข้มข้นของยาต้านจุลชีพ ที่สูงกว่าความเข้มข้นที่ใช้ในการป้องกันและรักษาโรคในมนุษย์และสัตว์”
ในช่วง 30 ปีที่ผ่านมา การดื้อยาต้านจุลชีพได้ทวีความรุนแรงมากขึ้นและยังไม่มีแนวโน้มจะลดลง ขณะที่อัตราการดื้อยาเพิ่มขึ้น แต่จำนวนยาปฏิชีวนะชนิดใหม่ที่ออกสู่ท้องตลาดกลับลดลง โดยจุลินทรีย์ที่พบว่ามีอัตราการดื้อยาต้านจุลชีพสูง คือ เชื้อแบคทีเรียแกรมลบที่ดื้อต่อยาปฏิชีวนะหลายขนานซึ่งกำลังเป็นภัยคุกคามอย่างสูงในขณะนี้ ขณะเดียวกันอุตสาหกรรมยาเห็นว่าการวิจัยและพัฒนายาปฏิชีวนะเป็นการลงทุนที่ไม่คุ้มค่า เพราะไม่นานเชื้อก็จะพัฒนาตัวเองให้ดื้อต่อยาใหม่นั้นได้อีก ส่งผลให้ตลาดยาปฏิชีวนะมีอายุสั้น จึงเป็นการลงทุนที่ไม่น่าสนใจเมื่อเทียบกับการลงทุนในกลุ่มยาที่ใช้รักษาโรคเรื้อรัง เช่น โรคเบาหวาน โรคความดันโลหิตสูง และโรคหัวใจ ที่สามารถขายและขยายตลาดได้เรื่อย ๆ
ปัจจุบัน ทั่วโลกมีคนเสียชีวิตจากการติดเชื้อดื้อยาประมาณปีละ 700,000 ราย และหากไม่มีการแก้ปัญหาอย่างจริงจัง คาดว่าการเสียชีวิตจะสูงถึง 10 ล้านคน ในปี ค.ศ. 2050 โดยทวีปเอเชียและแอฟริกาจะเสียชีวิตมากที่สุด คือ 4.7 และ 4.2 ล้านคน ตามลำดับ และคิดเป็นผลกระทบเชิงเศรษฐกิจสูงถึง 100 ล้านล้านดอลลาร์สหรัฐ องค์การอนามัยโลกระบุว่าแนวโน้มการดื้อยาที่เพิ่มขึ้นอย่างต่อเนื่องจะทำให้โลกเข้าสู่ยุคหลังยาปฏิชีวนะ (Post-antibiotic era) ที่การติดเชื้อแบคทีเรียเพียงเล็กน้อยอาจเป็นอันตรายถึงชีวิตได้ และเข้าสู่ภาวะถดถอยของการแพทย์แผนปัจจุบัน เนื่องจากไม่สามารถดำเนินขั้นตอนทางการแพทย์บางอย่างได้ เช่น การผ่าตัดทั่วไป การผ่าตัดเพื่อเปลี่ยนหรือเพื่อปลูกถ่ายอวัยวะ รวมทั้งการรักษามะเร็งด้วยเคมีบำบัด เพราะกระบวนการทางการแพทย์เหล่านี้ล้วนแต่ต้องพึ่งพิงประสิทธิภาพของยาปฏิชีวนะในการป้องกันและรักษาการติดเชื้อ
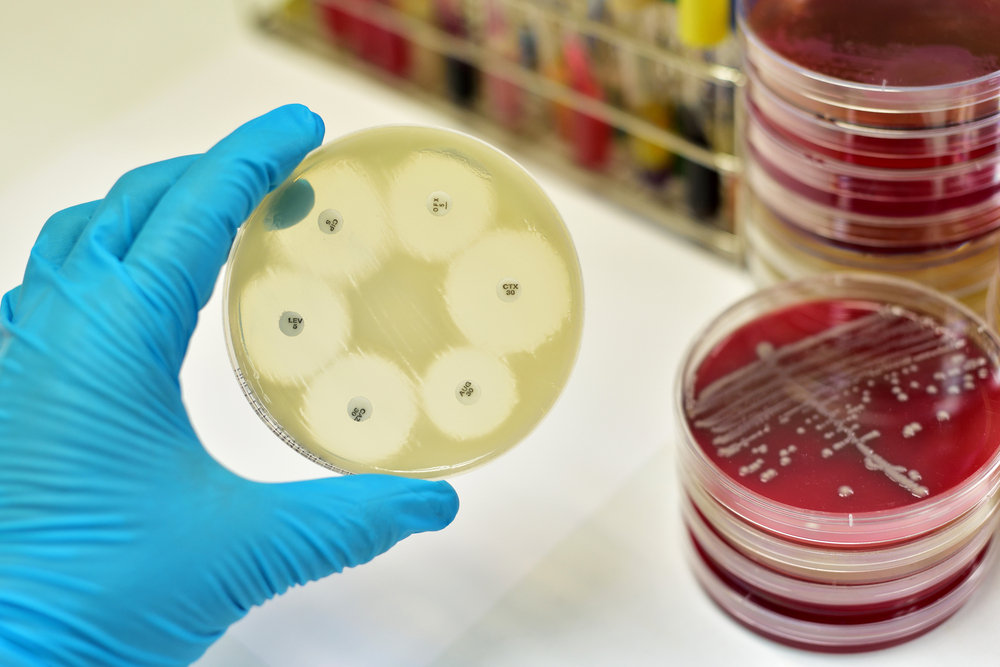
ทั่วโลกพบว่าในระยะ 10 ปีที่ผ่านมา การใช้ยาปฏิชีวนะในมนุษย์เพิ่มสูงขึ้น ถึงร้อยละ 36 และที่น่ากังวล คือ การใช้ยาปฏิชีวนะประเภท car-bapenems และ polymyxins เพิ่มขึ้นร้อยละ 45 และ 13 ตามล าดับ เพราะยา 2 ชนิดนี้คือยากลุ่มสุดท้ายสำหรับเชื้อแบคทีเรียดื้อยาชนิดรุนแรง (highly resistant bacteria) นอกจากนี้การใช้ยาปฏิชีวนะในการเกษตรและเลี้ยงสัตว์มีแนวโน้มจะเพิ่มขึ้นเช่นกัน โดยคาดว่าในปี 2573 จะมีการใช้ยาปฏิชีวนะในภาคการเกษตรเพิ่มขึ้นร้อยละ 67 ซึ่งก็เป็นสาเหตุหนึ่งที่ทำให้การดื้อยาต้านจุลชีพในอาหารและในสัตว์เพิ่มมากขึ้น
ในระดับโลก องค์การอนามัยโลก (World Health Organization,WHO) องค์การอาหารและเกษตร แห่งสหประชาชาติ (Food and Agriculture Organizationof the United Nations,FAO) และองค์การโรคระบาดสัตว์ระหว่างประเทศ (World Organisation for Animal Health,OIE) ได้ร่วมมือกันเพื่อแก้ปัญหาเชื้อดื้อยาต้านจุลชีพที่เป็นภัยคุกคามด้านสุขภาพของคนและสัตว์ภายใต้แนวทางสุขภาพหนึ่งเดียว (One Health) โดยในการประชุมสมัชชาอนามัยโลก สมัยที่ 67 มีมติให้ยกร่าง Global Action Plan on Antimicrobial Resistance (GAP-AMR) และมีมติรับรอง GAP-AMRในการประชุมสมัชชาอนามัยโลก สมัยที่ 68 และขอให้แต่ละประเทศสมาชิกจัดทำ National Action Plan on AMR
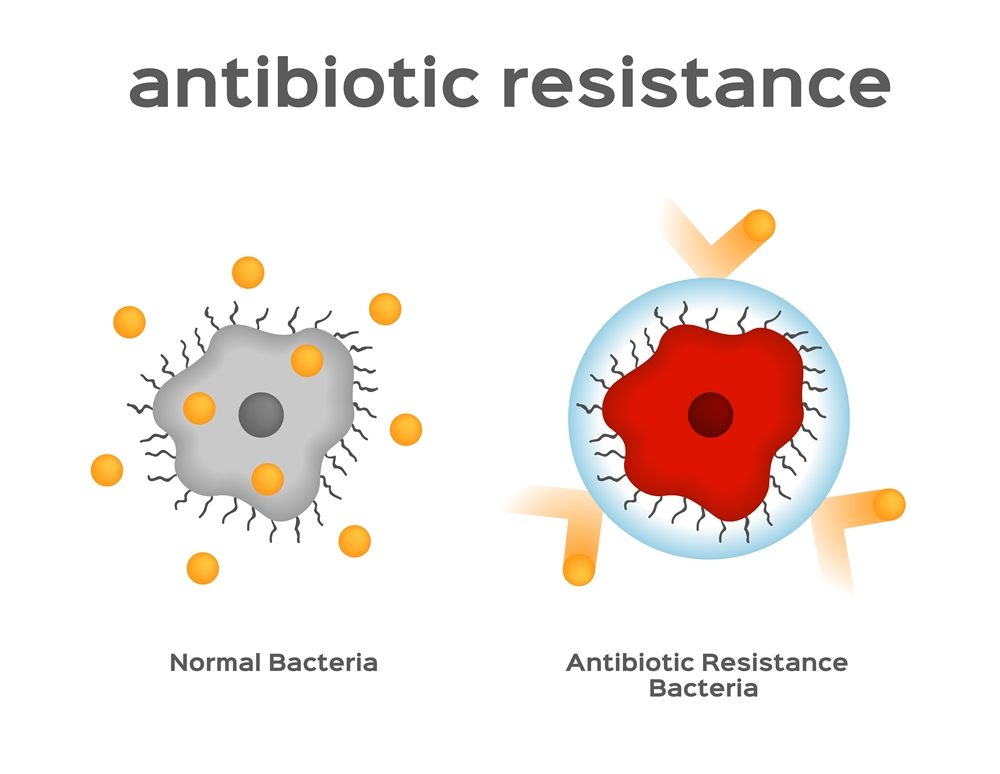
ผลการศึกษาจากหน่วยงานความปลอดภัยทางอาหารแห่งสหภาพยุโรป (EFSA) และ ศูนย์ควบคุมและป้องกันโรคแห่งสหภาพยุโรป (ECDC)ได้เน้นย้ำอีกครั้งว่า ภาวะการดื้อยาต้านจุลชีพสามารถก่อให้เกิดความเสี่ยงที่ร้ายแรงต่อสุขภาพของมนุษย์และสัตว์ โดยความเสี่ยงนี้ถูกระบุโดยคณะกรรมาธิการยุโรปว่าเป็นวาระสำคัญทางการเมืองด้านความปลอดภัยทางอาหาร นาย Vytenis Andriukaitis กรรมาธิการยุโรปด้านสาธารณสุขและความปลอดภัยอาหารได้กล่าวว่าในทุก ๆ ปี การติดเชื้อในยุโรปที่เกิดจากภาวะการดื้อยาต้านจุลชีพได้ส่งผลให้มีผู้เสียชีวิตประมาณ 25,000 ราย และความเสี่ยงนี้ก็ไม่ได้ถูกจำกัดอยู่แค่ในยุโรป แต่ถือว่าเป็นปัญหาระดับโลกซึ่งต้องการวิธีการแก้ไขในระดับโลกเข้ามาจัดการ
เป็นเวลานานที่สหภาพยุโรปได้ถือว่าเป็นแนวหน้าของโลกในการจัดการกับภาวะการดื้อยาต้านจุลชีพ โดยหน่วยงานหลัก 2 หน่วยงานของสหภาพยุโรปได้แก่ EFSA และ ECDC ได้ร่วมกันใช้ความเชี่ยวชาญในด้านสุขภาพของมนุษย์และสัตว์เพื่อไขปริศนาที่ซับซ้อนของภาวะการดื้อยาต้านจุลชีพ และให้คำแนะนำเชิงวิทยาศาสตร์แก่นักกำหนดนโยบาย
ในปัจจุบัน มีการเรียกร้องให้มีมาตรการจัดการกับปัญหาการดื้อยาต้านจุลชีพของแบคทีเรียที่มีอุบัติการณ์และความรุนแรงเพิ่มมากขึ้น ซึ่งรวมไปถึงการร่างสนธิสัญญาระหว่างประเทศเพื่อแก้ปัญหาด้านการดื้อยาของจุลชีพอย่างไรก็ตาม การดำเนินงานนี้จำเป็นต้องมีรายละเอียดและได้รับความสนใจจากภาคส่วนต่าง ๆ มากขึ้นเพื่อที่จะประมาณการและวัดแนวโน้มความรุนแรงของปัญหาดังกล่าวในระดับนานาชาติ โดยที่ผ่านมามีแนวคิดที่จะนำระบบการติดตามและประเมินผลการรักษามาใช้จัดการกับปัญหานี้ แต่การใช้งานจริงนั้นยังไม่อาจเกิดขึ้นได้มากเท่าใดนัก ซึ่งระบบในลักษณะนี้จะให้ข้อมูลเชิงลึกแก่พื้นที่ที่มีอัตราการดื้อยาต้านจุลชีพสูง รวมถึงข้อมูลที่จำเป็นส าหรับการประเมินการดำเนินงานและการเปลี่ยนแปลงอื่น ๆ ที่ทำขึ้นเพื่อต่อสู้หรือจัดการกับปัญหาการดื้อยาต้านจุลชีพของแบคทีเรีย
การป้องกันการดื้อยาต้านจุลชีพของแบคทีเรียนั้นสามารถกระทำได้หลายช่องทาง ได้แก่ ใช้ยาปฏิชีวนะเมื่อมีข้อบ่งใช้ที่เหมาะสม หยุดการใช้ยาปฏิชีวนะหรือยาต้านจุลชีพอื่นในทางที่ผิดหากเป็นไปได้ให้พิจารณาใช้ยาปฏิชีวนะชนิดออกฤทธิ์แคบ (Narrow-spectrum antibiotics) แทนยาปฏิชีวนะชนิดออกฤทธิ์กว้าง (Board-spectrum antibiotics) เนื่องจากการใช้ยาปฏิชีวนะชนิดออกฤทธิ์แคบจะมีความจำเพาะต่อเชื้อสาเหตุและมีประสิทธิภาพมากกว่า ซึ่งจะช่วยลดความเสี่ยงของการเกิดการดื้อยาต้านจุลชีพได้ ในกรณีที่ต้องรับประทานยาเองที่บ้าน ผู้ใช้ยาควรมีความตระหนักรู้ถึงวิธีการใช้ยาที่เหมาะสม และความเสี่ยงที่อาจเกิดขึ้นได้จากการใช้ยาดังกล่าวนอกเหนือจากคำแนะนำของบุคลการทางการแพทย์ นอกจากนี้ บุคลากรทางการแพทย์ซึ่งมีโอกาสสัมผัสกับเชื้อจุลชีพต่าง ๆ ในการทำงานก็ถือเป็นภาคส่วนที่สำคัญที่จะช่วยลดการแพร่กระจายของแบคทีเรียดื้อยาได้ โดยการรักษาสุขอนามัยและการมีระบบการสุขาภิบาลที่ดีในสถานพยาบาล ซึ่งรวมไปถึงการล้างมือและการทำให้ปราศจากเชื้อ (disinfecting) ในระหว่างการสัมผัสผู้ป่วยแต่ละราย รวมไปถึงการให้ความรู้เพื่อกระตุ้นความตระหนักรู้ในประเด็นดังกล่าวแก่ผู้ป่วย ญาติผู้ป่วย หรือบุคคลอื่นในสถานพยาบาล

นอกจากนี้วารสารทางการแพทย์ เช่น Lancet ได้นำเสนอกลยุทธ์สำคัญ 5 ประการที่จำเป็นสำหรับการลดอัตราการดื้อยาต้านจุลชีพของเชื้อแบคทีเรีย ดังนี้
• การเฝ้าระวังการใช้ยาปฏิชีวนะ เพื่อสงวนยาปฏิชีวนะที่มีอยู่ในปัจจุบันและที่อาจค้นพบใหม่ในอนาคตให้มีประสิทธิภาพในการรักษาโรคติดเชื้อแบคทีเรียต่าง ๆ ได้ดีเหมือนที่ผ่านมา
• มีการกำหนดกรอบเวลาที่จำเป็นต้องมีการสั่งจ่ายยาปฏิชีวนะที่มีประสิทธิภาพและเจาะจงกับเชื้อสาเหตุให้เร็วที่สุดเท่าที่เป็นไปได้
• พัฒนาและรับรองยาปฏิชีวนะชนิดใหม่ให้ได้ 10 ชนิดภายในปี ค.ศ. 2020
• พัฒนาวิธีการศึกษาพันธุศาสตร์ระดับโมเลกุลเพื่อตรวจหายีนของแบคทีเรียที่ก่อให้เกิดการดื้อยาต้านจุลชีพ
ซึ่งกลยุทธ์ข้อสุดท้ายเป็นสิ่งที่ทางหน่วยงานความปลอดภัยทางอาหารแห่งสหภาพยุโรปได้ศึกษาและเสนอให้มีการใช้เทคโนโลยีการหาลำดับเบสของสารพันธุกรรมทั้งหมด (Whole genome sequencing, WGS) เพื่อตรวจสอบและติดตามภาวะการดื้อยาต้านจุลชีพ
การหาลำดับเบสของสารพันธุกรรมทั้งหมดเป็นการศึกษาถึงสารพันธุกรรมทั้งหมดที่มีอยู่ในสิ่งมีชีวิตแต่ละชนิด โดยสถาบันสุขภาพแห่งชาติของสหรัฐอเมริกา (NIH) และกองทุนเวลคัมแห่งกรุงลอนดอนได้ร่วมมือกันเพื่อค้นหาลำดับเบสของสารพันธุกรรมทั้งหมดในมนุษย์ทั้ง 3 พันล้านเบส ได้ครบถ้วนสมบูรณ์แล้วตั้งแต่ ปี ค.ศ. 2003 ซึ่งต่อมาก็หลายสถาบันวิจัย และองค์กรรัฐได้เริ่มศึกษาการหาลำดับเบสของสารพันธุกรรมทั้งหมดในสิ่งมีชีวิตอื่น ๆ เช่น
- หนู มีจีโนมขนาดเล็กกว่ามนุษย์เล็กน้อย ขนาดของจีโนมประมาณ 3 พันล้านคู่เบส บรรจุอยู่ในโครโมโซม 20 คู่
- แมลงหวี่ Drosophila มีจีโนมขนาดประมาณ 160 ล้านคู่เบส และมีโครโมโซม 4 คู่
- หนอนตัวกลม C. elegans มีจีโนมขนาดประมาณ 100 ล้านคู่เบส
- ยีสต์ S. cerevisiae มีจีโนมขนาดประมาณ 12.5 ล้านคู่เบส
- แบคทีเรีย E. coli มีโครโมโซมเดี่ยว และมีจีโนมขนาดเล็กเพียง 5 ล้านคู่
ซึ่งการศึกษาจีโนมของแบคทีเรียที่ก่อให้เกิดโรค หรือแบคทีเรียที่มีการดื้อยาต้านจุลชีพ จะช่วยให้ระบุได้ว่ายีนตัวไหนที่เหนี่ยวนำให้เกิดการดื้อยาต้านจุลชีพกรรมวิธีในการถอดลำดับเบสของสารพันธุกรรมประกอบด้วย 3 ขั้นตอนหลัก คือ
1. หาการเรียงตัวของคู่เบส (sequencing) ทำโดยตัดเส้น DNA เป็นชิ้นเล็ก ๆ แล้วป้อนเข้าไปให้เครื่องอ่านอัตโนมัติอ่านเหมือนกับการแกะตัวอักษรทีละตัว เพื่อให้ได้ลำดับเบสของ DNA ชิ้นนั้น ๆ
2. จากนั้นนำตัวลำดับเบสที่ถอดมาแล้วในแต่ละชิ้นของเส้น DNA มาประกอบเรียงกันใหม่จนกระทั่งได้ลำดับคู่เบสของ DNA ทั้งหมด
3. เมื่อทราบการเรียงลำดับของ DNA ทั้งหมดแล้ว จึงค้นหาตำแหน่งของยีน ซึ่งมีอยู่เพียงประมาณร้อยละ ในข้อมูลจีโนมทั้งหมด ทั้งนี้อาจทำโดยการค้นหารหัสบ่งชี้การเริ่มต้นและสิ้นสุดของยีน หรือโดยการเปรียบเทียบกับยีนที่รู้จักแล้ว

เมื่อทราบรหัสพันธุกรรมของเชื้อจุลินทรีย์แล้วจะสามารถนำมาวิเคราะห์ได้ว่าเชื้อจุลินทรีย์เหล่านั้นเป็นอย่างไร พอทราบแล้วจะทำให้เราวางแผนในการจัดการกับเชื้อจุลินทรีย์นี้ได้ดีมากขึ้น โดยพัฒนาวิธีการรักษา ยา และวัคซีน ได้ถูกกับโรคมากขึ้น ความก้าวหน้าทางจีโนมดังที่ได้กล่าวมาแล้วจะทำให้เราสามารถค้นพบยาใหม่ ๆ ได้เร็วขึ้น เพื่อรับมือกับภาวะการดื้อยาต้านจุลชีพ ขณะนี้มีวัคซีนใหม่คือ วัคซีนดีเอ็นเอ (DNA vaccine) ที่ใช้การนำเอายีนของเชื้อจุลินทรีย์ฉีดเข้าสู่ร่างกาย เมื่อเข้าไปแล้วร่างกายของมนุษย์จะสร้างแอนติเจนจากยีนของเชื้อนั้นซึ่งจะไปกระตุ้นให้สร้างภูมิคุ้มกันไปป้องกันโรคได้
ผู้เชี่ยวชาญด้านการศึกษาสารพันธุกรรมสามารถใช้เทคนิคการหาลำดับเบสของสารพันธุกรรมเพื่อระบุหายีนต้านทานในแบคทีเรียที่ก่อให้เกิดการดื้อยาต้านจุลชีพ ซึ่งหน่วยงานความปลอดภัยทางอาหารแห่งสหภาพยุโรป (EFSA) ได้ระบุว่า เทคนิคนี้ถือว่าดีกว่าวิธีที่ใช้กันอยู่ในปัจจุบัน เพราะว่านอกจากจะระบุหาโอกาสการดื้อยาต้านจุลชีพของเชื้อแบคทีเรียได้มีประสิทธิภาพมากกว่า ยังสามารถสร้างข้อมูลจำนวนมาก ซึ่งสามารถนำไปต่อยอดในการศึกษาและการวิเคราะห์ทางระบาดวิทยาอื่น ๆ ได้อีกด้วย
หน่วยงานความปลอดภัยทางอาหารแห่งสหภาพยุโรปได้ระบุถึงความจำเป็นในการตรวจสอบการดื้อยาต้านจุลชีพของเชื้อแบคทีเรียในอาหารทะเล เพราะยังมีรายงานการศึกษาในอาหารประเภทนี้ไม่มากนักนอกจากนี้ในสหภาพยุโรปยังมีการขยายตัวของการเพาะเลี้ยงสัตว์น้ำ และการนำเข้าอาหารทะเลเป็นจำนวนมาก
นอกจากนี้ผู้เชี่ยวชาญยังเน้นย้ำถึงความสำคัญและความจำเป็นในการศึกษากระบวนการที่ก่อให้เกิดภาวะการดื้อยาต้านจุลชีพ และการแพร่กระจายการดื้อยาต้านจุลชีพไปยังสิ่งแวดล้อมหรือพื้นที่ที่มีการผลิตอาหาร
ท้ายสุด EFSA ได้ให้คำแนะนำว่า การตรวจสอบติดตามการดื้อยาต้านจุลชีพเป็นสิ่งที่จำเป็นมากในระบบสาธารณสุข และเทคนิคการหาลำดับเบสของสารพันธุกรรมจะช่วยให้เข้าใจกระบวนการพัฒนาการดื้อยาได้ดียิ่งขึ้น
