

 90,804 Views
90,804 Views
คำตอบคือ ไม่ใช่ทั้งสองอย่างค่ะ เพราะสีแปลก ๆ ของเปลวไฟที่เราเห็นนั้น เกิดจากการเผาไหม้ของธาตุโลหะต่างชนิดกัน ซึ่งวันนี้เราจะมาไขปริศนาเกี่ยวกับสีของเปลวไฟที่เกิดจากไอออนของโลหะ ใครที่เคยสงสัยต้องตั้งใจอ่านบทความนี้โดยด่วน เพราะวิทยาศาสตร์อาจไม่ได้อยู่แค่ในห้องทดลอง แต่อยู่รอบ ๆ ตัวเรานี่แหละค่ะ

หากเราเปิดตารางธาตุดูจะพบว่า ธาตุส่วนใหญ่บนตารางธาตุเป็นธาตุโลหะ ซึ่งโดยทั่วไปมีสมบัตินำไฟฟ้าและความร้อนได้ดี มีจุดหลอมเหลวสูง และมีลักษณะมันวาว อะตอมของธาตุที่เป็นโลหะจะมีการสูญเสียอิเล็กตรอนออกไปได้ง่ายเนื่องจากอิเล็กตรอนอยู่กันอย่างอิสระ จึงทำให้อะตอมของโลหะกลายเป็นไอออนบวก และเมื่อธาตุโลหะเหล่านี้รวมตัวกับธาตุอื่น ๆ ในตารางธาตุจนเกิดเป็นสารประกอบ วิธีหนึ่งที่จะช่วยให้เราทดสอบสารประกอบซึ่งมีธาตุโลหะเป็นองค์ประกอบได้ ก็คือ การเผาเพื่อตรวจดูสีของเปลวไฟ หรือที่เรียกว่า FlameTest
การเผาเพื่อตรวจดูสีของเปลวไฟ หรือ FlameTest เป็นการตรวจสอบและวิเคราะห์ เพื่อระบุไอออนของโลหะที่อยู่ในสารประกอบนั้น ๆ โดยการให้ความร้อนไปที่โลหะ สารประกอบที่มีไอออนของโลหะชนิดเดียวกันจะให้สีของเปลวไฟที่เหมือนกัน เรียกง่าย ๆ ว่า พอเผาโลหะนั้นปุ๊บ ได้สีอะไรออกมา ก็สามารถระบุได้ว่ามีธาตุโลหะชนิดใดเป็นองค์ประกอบอยู่นั่นเอง
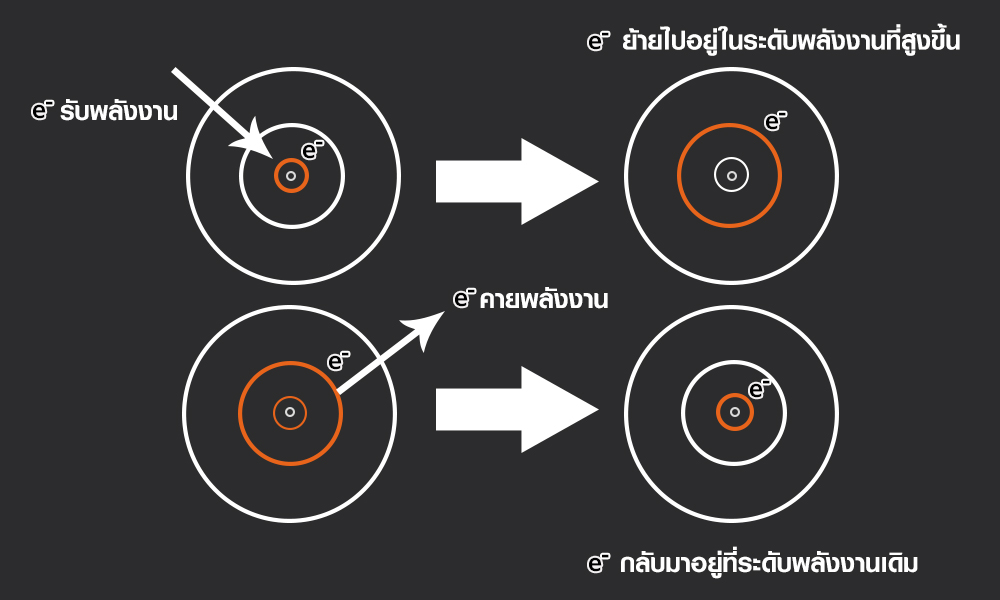
การที่ไอออนของธาตุโลหะทำให้สีของเปลวไฟแตกต่างกัน เพราะทันทีที่อะตอมที่ได้รับพลังงาน ไม่ว่าจะทั้งจากการเผาหรือจากกระแสไฟฟ้า อิเล็กตรอนจะมีพลังงานที่สูงขึ้น และจะดีดตัวเองไปอยู่ในระดับพลังงานที่สูงกว่าระดับพลังงานเดิม ทำให้อะตอมไม่เสถียร และเพื่อรักษาความเสถียรของอะตอม อิเล็กตรอนจึงต้องคายพลังงานออกมา พร้อมทั้งกลับลงมาอยู่ในระดับพลังงานที่ต่ำกว่าเดิม พลังงานที่อิเล็กตรอนคายออกมานั้นจะอยู่ในรูปพลังงานแสงหรือคลื่นแม่เหล็กไฟฟ้า นี่คือสาเหตุว่า ทำไมเปลวไฟถึงมีสีต่าง ๆ โดยสีที่เราเห็นนั้นเป็นคลื่นแสงที่มีความเข้มสูงสุด แต่เนื่องจากโลหะแต่ละชนิดมีระยะห่างระหว่างชั้นพลังงานไม่เท่ากัน จึงทำให้ไอออนของโลหะคายพลังงานออกมาในปริมาณที่ต่างกัน เกิดเป็นสีของเปลวไฟที่ต่างกัน
ตัวอย่างสีของสารประกอบโลหะ เช่น
- สารประกอบลิเทียม (Li) ให้เปลวไฟสีแดง
- สารประกอบโซเดียม (Na)ให้เปลวไฟสีเหลือง
- สารประกอบโพแทสเซียม (K) ให้เปลวไฟสีม่วง
- สารประกอบรูบิเดียม (Rb) ให้เปลวไฟสีแดงเข้ม
- สารประกอบซีเซียม (Cs) ให้เปลวไฟสีฟ้า
- สารประกอบแคลเซียม (Ca) ให้เปลวไฟสีแดงอิฐ
- สารประกอบแบเรียม (Ba) ให้เปลวไฟสีเขียวแกมเหลือง
- สารประกอบทองแดง (Cu) ให้เปลวไฟสีเขียว
- สารประกอบแมกนีเซียม (Mg) ให้เปลวไฟสีขาว
- สารประกอบเหล็ก (Fe) ให้เปลวไฟสีทองหรือน้ำตาลเหลือง
ยกตัวอย่างแคลเซียมคลอไรด์ (CaCl2) เมื่อนำไปเผาจะได้เปลวไฟสีแดงอิฐ เนื่องจากว่ามีแคลเซียม (Ca) เป็นองค์ประกอบ หรืออีกตัวอย่างหนึ่ง คือโพแทสเซียมไนเตรต (KNO3) ซึ่งเมื่อนำไปเผาจะได้เปลวไฟสีม่วงเพราะมีโพแทสเซียมเป็นองค์ประกอบนั่นเอง
เมื่อการเผาโลหะให้เปลวไฟที่มีสีต่าง ๆ บางคนอาจสงสัยว่า ทำไมไม่พูดถึงสีของเปลวไฟจากการเผาอโลหะบ้างล่ะ เหตุผลก็คือ การเผาสารประกอบอโลหะ จะเกิดสีเช่นเดียวกัน แต่เป็นสีสเปกตรัมที่อยู่ในช่วงที่ตาของมนุษย์เรามองไม่เห็น ฉะนั้นในการทดลองในห้องวิทยาศาสตร์ในโรงเรียน จึงเน้นอะไรที่เราสามารถเห็นผลได้ทันที อย่างสารประกอบโลหะที่ทุกคนสามารถสังเกตสีได้พร้อม ๆ กัน
อย่างที่บอกไปในตอนแรกว่า วิทยาศาสตร์อยู่รอบตัวเรา เพราะจริง ๆ แล้วเรื่องสีของเปลวไฟที่เกิดจากไอออนของโลหะที่ดูเหมือนซับซ้อนและไม่เกี่ยวกับชีวิตประจำวันของเรา แต่หากเพียงแค่เราเงยหน้าขึ้นมองท้องฟ้าในยามที่มีเทศกาลเฉลิมฉลอง พลุหลากสีบนฟ้า อาจจะใช้หลักการเดียวกับเรื่องที่เราอ่านวันนี้ก็เป็นได้ เพราะวิทยาศาสตร์อยู่ทุกที่มากกว่าแค่ห้องทดลอง
บทความที่เกี่ยวข้อง
- ทำไมพลุถึงมีสีต่าง ๆ กัน
